Слайд 2Классификация
Оксиды
(ЭхОу)
Кислоты
(Н+кисл.ост)
Соли
(Ме+кисл.ост)
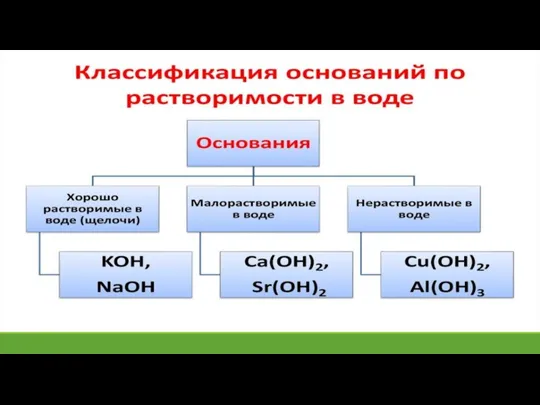
Основания
(Ме+ОН)

Слайд 3ОКСИДЫ
Кислотные
НемеО
Пример: СО2; SO3; N2O5
Основные
МеО
Пример: СаО; FeO.

Слайд 4Задание: Выпишите оксиды в столбик, напротив формулы запишите характер оксида, дайте ему

название:BaO, CaO, P2O5, SiO2, Li2O, CuO, MgO,SO2, WO3, ZnO,Br2O7
Слайд 5 Основным оксидам соответствуют основания: Na2O + H2O = 2NaOH
Кислотным оксидам соответствуют кислоты(кислородсодержащие):

SO3 + H2O → H2SO4
Слайд 6Задание: Составьте уравнения реакции взаимодействия следующих оксидов с водой. Дайте названия продуктам

реакции.
K2O+ H2O->
CO2+H2O->
Li2O+H2O->
P2O5+H2O->
N2O5+H2O->
MgO+H2O->
Слайд 8С помощью каких (не менее трех) химических реакций можно получить:
А) Оксид алюминия
Б)

Оксид кальция
В) Оксид углерода(IV)
Слайд 9Кислоты
По содержанию атомов кислорода
Бескислородные
Кислородсодержащие
По числу атомов водорода
* Одноосновные
* Двухосновные
* Трехосновные

Слайд 10Задание: В соответствии с классификацией охарактеризуйте следующие кислоты:
HNO3, HF ,HCl, HBr ,HI,

H2SO4, H2SO3, H2S ,H2CO3 , H2SiO3.
Дайте им названия.
Слайд 11Кислоты взаимодействуют с металлами. Для взаимодействия кислот с металлами должны выполнятся некоторые

условия:
металл должен быть достаточно активным по отношению к кислотам (в ряду активности металлов он должен располагаться до водорода). Чем левее находится металл в ряду активности, тем интенсивнее он взаимодействует с кислотами;
При протекании химических реакций кислоты с металлами образуется соль и выделяется водород
Слайд 12Составьте уравнения:
С какими металлами будет вступать в реакцию H2SO4, назовите продукты

реакции.
Ag, Ca, Mg, Sn, Cu, Hg, Au, Ni.
Слайд 13Кислоты вступают в реакцию нейтрализации
Реакция нейтрализа́ции (от лат. neuter — ни тот,

ни другой) — реакция взаимодействия кислоты и основания между собой с образованием соли и воды.
Реакция нейтрализации является разновидностью реакции обмена.
Пример: KOH+HCl ->KCl+H2O (образовались соль - хлорид калия и вода)
Слайд 14Составить уравнения реакции между:
Соляная кислота и гидроксид магния
Серная кислота и гидроксид натрия
Азотная

кислота и гидроксид цинка
Фосфорная кислота и гидроксид железа(II)
Угольная кислота и гидроксид кальция.
Дать название продуктам реакции
Слайд 16КОН- гидроксид калия. (валентность калия постоянная, поэтому в названии ее указывать не

нужно; валентность ОН – группы всегда равна 1)
Fe(OH)3 - гидроксид железа(III) –валентность железа 3, а ОН группы 1, поэтому ОН взяли в скобки и за ними поставили индекс 3. В названии указываем валентность, потому что у железа она переменная
Слайд 17Задание. Дать название следующим соединениям:
Fe(OH)2 ; Fe(OH)3 ; Al(OH)3; LiOH; NaOH; KOH;

RbOH; CsOH; Ca(OH)2; Sr(OH)2; Ba(OH)2.
Слайд 19Решить цепочки превращений, дать названия веществам, указать тип химической реакции:
Сa->CaO->Ca(OH)2->CaO
ZnO->ZnCl2->Zn(OH)2->ZnO

Слайд 21Назовите следующие соли:
NaNO3, K3PO4, CuSO4, Li3PO4, CaCO3, AgCl,
*Название солям дается от названия

кислотного остатка. Валентность металла указывается в скобках в том случае, если она переменная. Валентность кислотного остатка определяем по формуле соответствующей кислоты (число атомов водорода)
Слайд 22Составьте формулы солей по их названию:
Фосфат марганца(IV)
Сульфат магния
Нитрат цинка
Хлорид железа (III)
Сульфат хрома

(III)
Карбонат калия
Силикат калия
Фосфат меди(II)
Сульфид никеля (II)
Сульфит алюминия





















 Агрегатные состояния веществ
Агрегатные состояния веществ Нефть. Свойства нефти
Нефть. Свойства нефти Атомы химических элементов
Атомы химических элементов Фенолы и их применение
Фенолы и их применение Титан. История открытия титана
Титан. История открытия титана Курсовая работа: синтез 3,5-диметилпиразола
Курсовая работа: синтез 3,5-диметилпиразола Алюминий
Алюминий Презентация Продукции Opet (3)
Презентация Продукции Opet (3) Соединения железа. 9 класс
Соединения железа. 9 класс Химическое равновесие
Химическое равновесие Трансляция. Активизирование аминокислоты
Трансляция. Активизирование аминокислоты Алканы. Циклоалканы
Алканы. Циклоалканы Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году
Методические рекомендации по преподаванию учебного предмета Химия в 2021-2022 учебном году Классификации по атомному весу
Классификации по атомному весу География. Уральские самоцветы
География. Уральские самоцветы Парфюмерные товары
Парфюмерные товары Строение и свойства циклоалканов
Строение и свойства циклоалканов Химический анализ. Исследовательская деятельность (8 класс)
Химический анализ. Исследовательская деятельность (8 класс) Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Уравнение состояния
Уравнение состояния Графен. Нобелевская премия 2016
Графен. Нобелевская премия 2016 Химические формулы CaO
Химические формулы CaO Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби
Нітратна кислота Презентація вчителя хімії Смілянської загальноосвітньої школи І-ІІІ ст. № 11 Л.В.Заруби Спирты. Классификация
Спирты. Классификация Классификация органических веществ
Классификация органических веществ Классификация органических соединений
Классификация органических соединений Пименов_Химический состав
Пименов_Химический состав Жидкое агрегатное состояние вещества. Растворы
Жидкое агрегатное состояние вещества. Растворы