Слайд 2 ПЛАН:
Химические методы. Использование в практике.
Теоретические основы гравиметрического метода анализа

Основные этапы методики гравиметрического анализа
Расчет результатов гравиметрического анализа
Погрешности метода
Слайд 3Химические методы
Химические методы основаны на химических превращениях исследуемого вещества, протекающих с образованием

или участием малорастворимых соединений, слабых электролитов, окрашенных комплексов или газообразных веществ.
Химические процессы, используемые в целях анализа, называют аналитическими реакциями. К аналитическим реакциям предъявляются специальные требования, которые зависят от задач выполняемого анализа.
Химические методы считаются классическими и тщательно выверены практикой. Тем не менее, во многих случаях оперативность, точность или чувствительность этих методов недостаточна.
Слайд 12Теоретические основы гравиметрического метода анализа
В гравиметрическом анализе используется прямое определение массы вещества

при помощи взвешивания.
Определение массы является и начальной, и конечной стадией анализа.
Основной прибор – аналитические весы.
Слайд 13Гравиметрический метод анализа основан на законах:
сохранения массы вещества при химических превращениях;
постоянства

состава;
законе эквивалентов.
В основе гравиметрического метода анализа лежат различные химические реакции
разложения, замещения
обмена
комплексообразования.
Слайд 14Типы гравиметрических определений.
Метод отгонки
Определение зольности угля, сланца, торфа
Для этого

навеску анализируемой пробы взвешивают, сжигают (муфельный шкаф, Т>500-600°C)и золу опять взвешивают.
Обязательное условие – взвешивание до постоянной массы (∆m≤ 0,0002г–Sr – величина погрешности взвешивания на аналитических весах).
Слайд 15Типы гравиметрических определений.
Метод отгонки
Определение влажности (влаги), кристаллизационной воды
После взвешивания навески

пробы определяемую составную часть удаляют при нагревании (сушильный шкаф, Т ≥ 105±5°С), а остаток взвешивают
Обязательное условие – взвешивание до постоянной массы (∆m≤ 0,0002г – Sr – величина погрешности взвешивания на аналитических весах).
Слайд 16 Типы гравиметрических определений.
Метод осаждения – основной метод гравиметрии
Определяемую составную часть

осаждают в виде химического соединения со строго определенным составом.
Полученный осадок отделяют и промывают, высушивают и взвешивают.
Обязательное условие – взвешивание до постоянной массы ( ∆m ≤ 0,0001г – Sr– величина погрешности взвешивания на аналитических весах).
Слайд 17Типы гравиметрических определений.
Метод осаждения – основной метод гравиметрии
Важнейшим этапом гравиметрического определения

в методе осаждения является получение осадка, без примесей и крупнокристаллического
Отношение F-величина постоянная и называется гравиметрическим фактором (в аналитических справочниках – аналитический (стехиометрический) множитель)
Слайд 18Типы гравиметрических определений.
Метод осаждения – основной метод гравиметрии
Требования, предъявляемые к осаждаемой

форме (ОсФ) в гравиметрии
Осадок должен быть достаточно малорастворим. В растворе после осаждения может оставаться не более 1·10-4 г (величина погрешности взвешивания на аналитических весах) массы аналита, т.е. не более 1·10-6 М – условие полного осаждения!!!.
Желательно, чтобы осадок был крупнокристаллическим, т.к. такой осадок проще промывать и отделять.
Осадок не должен поглощать из раствора примеси.
Осадок должен иметь постоянный состав.
ОсФ должна легко и просто превращаться в весовую (гравиметрическую). Например, ОсФ Fe2O3 ·x H2O при прокаливании легко превращается в весовую форму Fe 2O3 со строго определенным составом.
Осаждаемая форма может соответствовать гравиметрической
Слайд 19Требования, предъявляемые к гравиметрической форме (ГФ)
Точное соответствие состава химической формуле.
Достаточная

термическая и химическая устойчивость, т.е. ГФ осадка не должна поглощать из воздуха СО2 и Н2О, не должна окисляться и т.д.
Содержание определяемого элемента в ГФ должно быть как можно меньшим, а М гр.ф. – как можно большим, т.к. в этом случае погрешности взвешивания меньше скажутся на результатах анализа.
Необходимая для гравиметрического определения масса ГФ определяется, с одной стороны, погрешностью весов, с другой - оптимальной массой осаждаемой формы. Погрешность обычных аналитических весов – Sr =1-2 × 10-4 г. Поскольку относительная погрешность определения обычно не превышает 0,1%, погрешность взвешивания должна составлять не больше 0,1% от минимальной массы ГФ.
Обычно рекомендуемая масса ГФ для кристаллических осадков не превышает > 0,5 г, а для аморфных > 0,1 г.
Слайд 20Осаждение.
Факторы, влияющие на полноту осаждения осадка
Количество осадителя
Солевой эффект
Наличие посторонних ионов в

растворе повышает растворимость осадков за счет увеличения ионной силы раствора. Чем больше концентрация индифферентных ионов в растворе, тем меньше величины коэффициентов активности, и тем сильнее отличаются величины активности ионов от их концентраций
Чем меньше коэффициент активности, тем больше растворимость соединений
Слайд 21Осаждение.
Факторы, влияющие на полноту осаждения осадка
3. Температура раствора
При увеличении

температуры от 100 до 10000С растворимость BaSO 4 увеличивается в 1,8 раз; растворимость AgCl увеличивается в 25 раз; растворимость же СaSO 4 сначала увеличивается, а потом уменьшается.
Слайд 22Осаждение.
Факторы, влияющие на полноту осаждения осадка
4. Кислотность раствора
Величина рН раствора

сильно влияет на полноту осаждения осадков, в состав которых входят анионы слабых кислот или группа ОН -.
Величина рН раствора оказывает влияние на полноту осаждения осадков, в состав которых входят анионы сильных кислот. Некоторые соли растворяются в избытке кислоты-осадителя по причине
комплексообразования
образования кислых солей
солевого эффекта
Слайд 23Осаждение.
Факторы, влияющие на полноту осаждения осадка
5. Образование коллоидных систем
Такие осадки,

как Al(OH) 3, Fe(OH) 3, AgCl, склонны образовывать коллоидные растворы, которые легко переходят в фильтрат, приводя тем самым к большим потерям. В этом случае необходимо принимать особые меры по разрушению коллоидов, то есть образованию устойчивых гелей.-. Осаждение проводят в присутствии сильных электролитов
6. Размеры частиц образуемого осадка
Полнота осаждения зависит от размеров частиц осадка, т.е. от дисперсности частиц. Крупные частицы менее растворимы, чем мелкие, поэтому очень важно получить по возможности более крупные частицы осадка
Слайд 24Механизм образования осадков.
Теория кристаллизции.
Ag+ + Cl- =AgCl
Ba2+ +SO42- =BaSO4
На первый взгляд, образование

осадков идет по одинаковому механизму: ион Ag+ или Ba2+ взаимодействуют с одним ионом Cl- или SO42- и выпадают в осадок.
На самом деле осадки AgCl и BaSO4 состоят отдельных кристаллов, включающих в себя огромное число ионов, расположенных строго определенным образом.
Сначала образуются зародышевые кристаллы, которые не могут выпадать в осадок (кластеры).
Затем идет постепенное укрупнение, в результате образуются осадки двух типов: аморфные и кристаллические.
Слайд 25Механизм образования осадков.
Теория кристаллизации.
1-я стадия. Дегидратация ионов
2-я стадия. Образование первичных центров

кристаллизации (зародыша-кластера) (Ba2+ SO42- )n=4-5
3-я стадия. Рост кластеров за счет осаждения на них все большего кол-ва ионов, образование крупных агрегатов, но выделения осадка еще нет – Коллоидная стадия образования осадка.
4-я стадия. Образование во времени нескольких крупных кристаллов или их агрегатов, которые уже не удерживаются в растворе, выделяются в виде осадка
Слайд 26Кристаллические осадки.
При образовании кристаллических осадков выделение вещества из раствора идет на поверхности

уже образовавшихся зародышей, за счет их постепенного роста.
Условия образования:
1.Использование разбавленных и нагретых растворов пробы и осадителя, т.к. более крупные кристаллы образуются в растворе, содержащем меньшее число зародышей, а также предварительное подкисление раствора пробы.
2.Медленное добавление осадителя (в первые моменты буквально по каплям) с целью предотвратить образование большого количества зародышевых частиц.
3.Постоянное перемешивание раствора, препятствующее образованию новых зародышей.
4.Использование стадии «старения» осадка. В ходе «старения - созревания» мелкие кристаллы растворяются, а крупные кристаллы – увеличиваются из-за обмена ионов кристаллической решетки с ионами раствора на поверхности кристалла, при этом осадок очищается, примеси переходят в раствор.
Слайд 27Гомогенное осаждение.
Получение крупнокристаллических осадков.
Метод «возникающих реагентов» Принцип – обеспечить min величину
относительного пересыщения (Q-S)/S.
Слайд 28Гомогенное осаждение.
Получение крупнокристаллических осадков.
Способы:
Регулирование рН раствора;
Постепенное генерирование осаждаемого аниона или катиона

в растворе;
Синтез реагента в растворе;
Испарение растворителя.
Слайд 29Аморфные осадки
При образовании аморфных осадков в первый же момент слияния растворов образуется

большое количество зародышевых кристаллов, впоследствии соединяющиеся (слипающиеся) в более крупные агрегаты, которые и оседают на дно.
Таким образом, аморфные осадки фактически состоят из мельчайших кристаллов. Псевдокристаллические осадки.
Слайд 30Аморфные осадки
Процессы, происходящие при образовании аморфных осадков
Коагуляция - слипание мелких частиц

в крупные агрегаты (с определенным электрическим зарядом), оседающие из раствора в виде хлопьев (т.наз. Гель).
Пептизация – обратный процесс разрушения (растворения)осадка, превращение геля в коллоид из-за потери электрического заряда.
Слайд 31Аморфные осадки
Условия образования:
Обязательное присутствие электролита-коагулятора (соли аммония и кислоты).
Осаждение из концентрированных

растворов при нагревании для разрушения гидратной оболочки коллоидных частиц и одновременного уменьшения адсорбции ионов, которые придают коллоидным частицам заряд и препятствуют процессам слипания.
Быстрое приливание осадителя для получения максимального количества зародышевых кристаллов.
Добавление сразу по окончании осаждения большого количества горячей воды для вымывания примесей с поверхности осадка (из-за быстрого добавления осадителя происходит усиление адсорбции).- Прием Коренмана
Отделение осадка от маточного раствора (фильтрованием) сразу по окончании осаждения для предотвращения «созревания» - загрязнения осадка примесями из раствора.
Слайд 32Загрязнение осадков
Соосаждение - попадание в осадок посторонних компонентов, содержащихся в растворе, которые

сами по себе в данных условиях осадка не образуют.
Основная причина – адсорбция развитой поверхностью осадка ионов из маточного раствора.
Правила Панета-Фаянса-Гана преимущественной адсорбции:
собственные ионы осадка;
посторонние ионы, способные к образованию малодиссоциированных соединений с ионами осадка;
посторонние ионы с большим зарядом и размерами;
ионы с большей концентрацией в растворе.
Предотвращение соосаждения:
Получение крупнокристаллических осадков при повышенной Т°С, 2)
Промывание осадка,
Перекристаллизация (старение) осадка
Слайд 33Загрязнение осадков
Различают следующие виды соосаждения: адсорбцию, изоморфизм, окклюзию и послеосаждение.
1. Адсорбция

- поглощение примесей поверхностью частиц осадка.
Возможность загрязнения вследствие адсорбции наиболее вероятна для мелкокристаллических осадков. Т.к. адсорбция – экзотермический процесс, то понижение температуры способствует увеличению сорбции. Нагревание, наоборот, усиливает десорбцию.
С повышением температуры количество адсорбированных примесей уменьшается.
Слайд 34Загрязнение осадков
2. Окклюзия - механический захват примесей при образовании осадка. Окклюдированные вещества

находятся внутри частиц осадка, но не участвуют в построении кристаллической решетки.
Причина – быстрый рост кристаллов или агрегатов осадка
Предупреждение окклюзии- медленное добавление осадителя.
Устранение окклюзии:
1)Переосаждение осадка;
2)Перекристаллизация (старение) осадка
Слайд 35Загрязнение осадков
Механический захват примесей маточного раствора и молекул растворителя характерен для

образования аморфных осадков
Слайд 36Загрязнение осадков
3. Образование смешанных (изоморфных) кристаллов (изоморфное соосаждение)
Причина изоморфизма – близость

величин зарядов и размеров основных ионов осадка и посторонних ионов.
Пример: розовый цвет осадка BaSO4 в присутствии KMnO4 или желтый – в присутствии К2CrO4.
Предотвращение изоморфизма– удаление посторонних ионов из раствора до начала осаждения.
Слайд 37Загрязнение осадков
4. Последующее осаждение - это процесс перехода примесей в осадок при

длительном контакте с раствором.
Пример: Осаждение на поверхности CaC2O4 c Ks =2,310-9 осадка MgC2O4 c Ks =8,510-5.
Предупреждение последовательного осаждения:
1)отделение осадка от раствора сразу после осаждения;
2)переосаждение осадка.
Слайд 38Фильтрование и промывание осадков
Фильтрование – отделение твердой фазы осадка от маточного раствора.

Для ускорения фильтрования проводят декантпацию.
Декантация – сливание жидкости с отстоявшегося осадка.
Для отделения осадка применяют следующий фильтрующий (пористый) материал : бумага (беззольные фильтры разной плотности – маркировка по цвету упаковки: черная, синяя, красная, белая и желтая «лента»), вата, ткань, стекло (фильтры пористые Шотта), фарфор (керамиковые фильтры и тигли фильтрующие Гуча), асбест.
Материал фильтра определяют:
-свойства и структура осадка;
-размер частиц;
-температура дальнейшей обработки осадка.
Скорость фильтрования определяют:
-величина частиц осадка;
-структура осадка;
-условия фильтрования.
Слайд 39Фильтрование и промывание осадков
Промывание – очищение осадка от остатков маточного раствора и

сорбированных примесей.
Промывная жидкость выбирается по типу промываемого осадка.
Для аморфных осадков – растворы сильных электролитов (для предотвращения пептизации).
Для кристаллических осадков – очищенная вода, разбавленные растворы осадителей (для уменьшения растворимости).
Слайд 40Высушивание и прокаливание осадков
Условия выбирают на основании термогравиметрических исследований (анализ термограммы).
Продолжительность

устанавливают экспериментально (до достижения постоянной массы).
Термически нестойкие осадки высушивают на воздухе или в эксикаторах над осушителями.
Т.к. возможно промывание осадков не водой и водными растворами, а спиртом или эфиром высушивают в эксикаторах и сушильных шкафах.
Слайд 41 Расчеты в гравиметрическом анализе
В гравиметрии используют фактор пересчета, называемый гравиметрическим

фактором - F.
Фактор пересчета (F) представляет собой отношение атомной (или молекулярной) массы определяемого вещества к молекулярной массе вещества, находящегося в осадке:
F =А/М
Если известно значение гравиметрического фактора F, то массу определяемого компонента т(Х) в анализируемом образце рассчитывают по формуле: т(Х) = F∙т(г.ф.),
где т(г.ф.)- масса гравиметрической формы .
Пользуясь факторами пересчета, делают вычисления по готовым формулам. Например, чтобы вычислить содержание элемента (или другой составной части) в сложном веществе, используют формулу:
% = (mF/G)•100,
где m— масса полученного осадка, г;
F — фактор пересчета;
G — навеска исследуемого вещества, г.
Слайд 42Погрешности гравиметрического анализа
Причины систематических погрешностей:
-потери от растворимости (неправильный выбор промывной жидкости

или фильтра);
-неполное превращение ОсФ в ГФ;
-неустойчивость ГФ при хранении;
-недостаточное охлаждение перед взвешиванием;
-применение загрязненных реактивов и т.д.
Способ выявления систематической погрешности – проведение холостого опыта через все стадии анализа.









































 Полистирол. Оформление мини-реферата по химии
Полистирол. Оформление мини-реферата по химии Природные смолы: мирра, ладан и шеллак
Природные смолы: мирра, ладан и шеллак ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Prezentatsia_lektsia_Reaktora_2_Materialny_balans
Prezentatsia_lektsia_Reaktora_2_Materialny_balans Презентация по Химии "Группа веществ, не требующих особых методов изолирования"
Презентация по Химии "Группа веществ, не требующих особых методов изолирования"  Метелёва И.Е. учитель химии
Метелёва И.Е. учитель химии Галогены
Галогены Вебинар. Гидролиз солей
Вебинар. Гидролиз солей Ионные уравнения реакций
Ионные уравнения реакций Неньютоновская жидкость
Неньютоновская жидкость Побочная подгруппа VIII группы
Побочная подгруппа VIII группы Строение атома
Строение атома Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии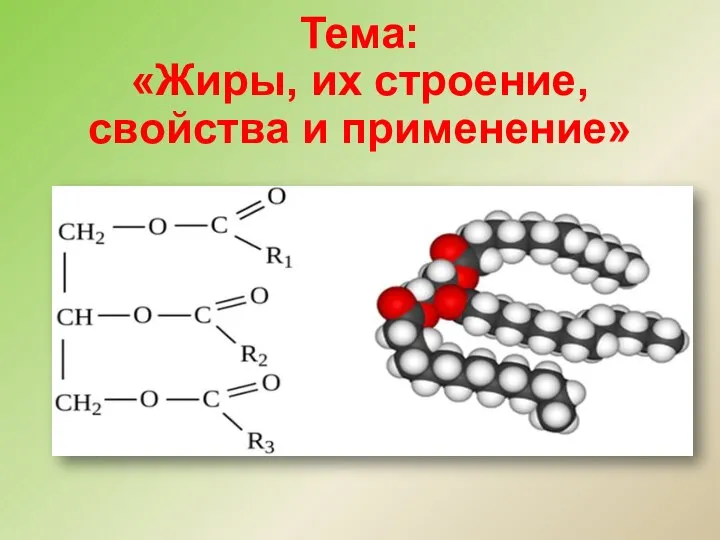 Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Соли. Формула соли
Соли. Формула соли Соединения щелочных металлов
Соединения щелочных металлов Алканы. Строение
Алканы. Строение Комплексные соли. 11 класс
Комплексные соли. 11 класс Презентация на тему Уксусная кислота
Презентация на тему Уксусная кислота  Минерал Александрит
Минерал Александрит Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс День химии
День химии Свойства воды
Свойства воды Строение вещества. Молекулы
Строение вещества. Молекулы Методика изготовления сенсора
Методика изготовления сенсора Спирты и их производные. Применение метанола и этанола
Спирты и их производные. Применение метанола и этанола Спирты
Спирты Константы диссоциации и PH
Константы диссоциации и PH