Содержание
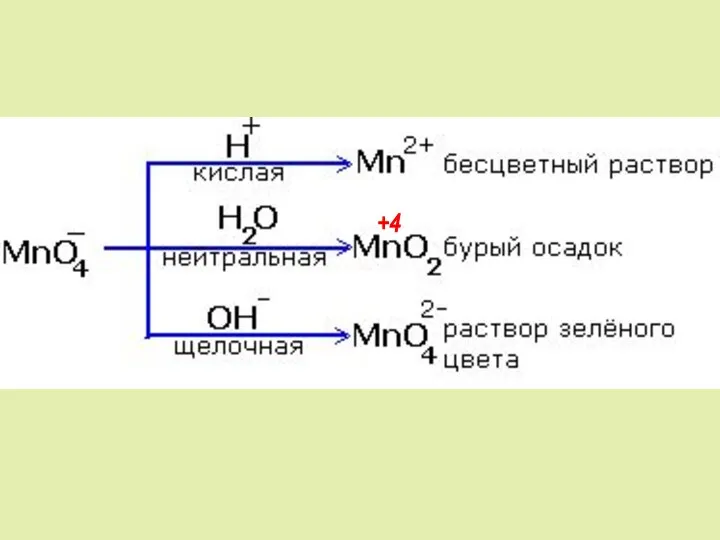
- 2. +4
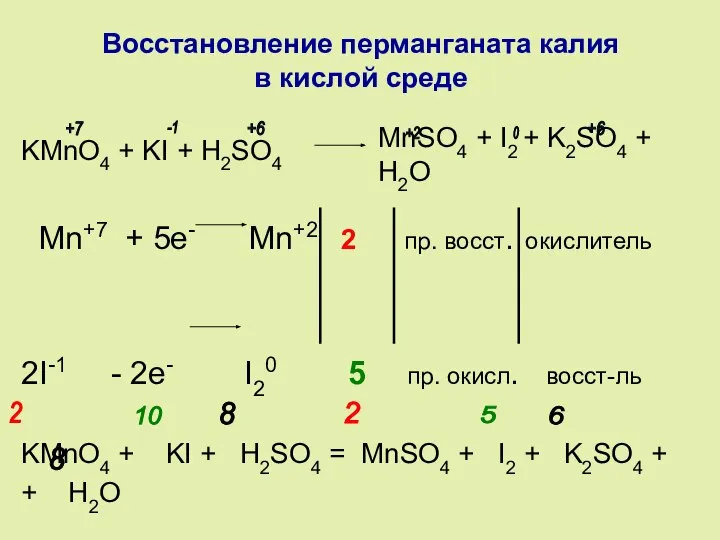
- 3. Восстановление перманганата калия в кислой среде KMnO4 + KI + H2SO4 Mn+7 + 5e- Mn+2 2
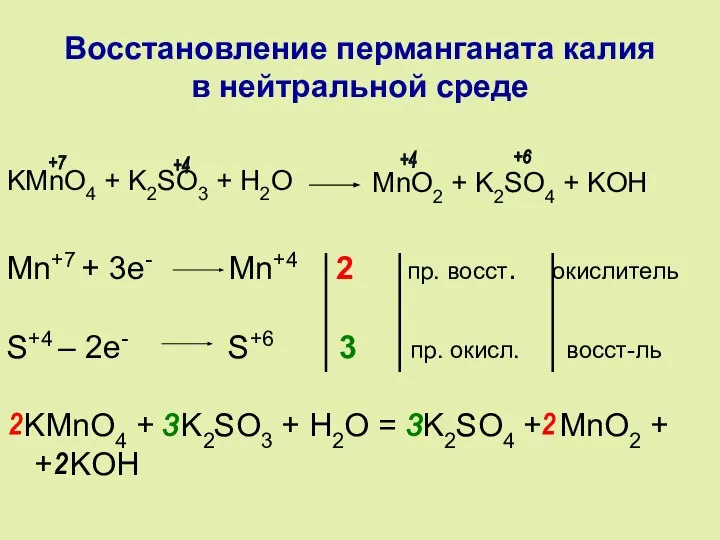
- 4. Восстановление перманганата калия в нейтральной среде KMnO4 + K2SO3 + H2O M Mn+7 + 3e- Mn+4
- 5. Восстановление перманганата калия в щелочной среде KMnO4 + K2SO3 + KOH Mn+7 +1e- Mn+6 2 пр.
- 7. Скачать презентацию

 Константы диссоциации и PH
Константы диссоциации и PH Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики
Предмет задачи, разделы, методы физической химии. Основные понятия и законы химической термодинамики Презентация на тему Угольная кислота и её соли (9 класс)
Презентация на тему Угольная кислота и её соли (9 класс)  Производство чугуна и стали
Производство чугуна и стали Реакции поликонденсации
Реакции поликонденсации Азот в сельском хозяйстве
Азот в сельском хозяйстве Типичные реакции оснований
Типичные реакции оснований Геохимический анализ поверхностных вод Звенигородской биостанции
Геохимический анализ поверхностных вод Звенигородской биостанции Строение бензола
Строение бензола Основания и их свойства
Основания и их свойства Презентация на тему Правила безопасности труда в кабинете химии
Презентация на тему Правила безопасности труда в кабинете химии  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Cкорость химических реакций
Cкорость химических реакций bc95487a97b0472591b20aef8d569081
bc95487a97b0472591b20aef8d569081 Получение, свойства и применение алкенов
Получение, свойства и применение алкенов Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов знаки химических элементов,относительная атомная масса
знаки химических элементов,относительная атомная масса Аммиак: состав, строение, свойства, применение
Аммиак: состав, строение, свойства, применение Химические реакции. Классификация
Химические реакции. Классификация Нефть - черное золото
Нефть - черное золото Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева
Презентация на тему Интересные факты из жизни великого учёного Д. И. Менделеева  Типы химических реакций
Типы химических реакций Оценивание эффективности многофункциональной присадки для бензинов
Оценивание эффективности многофункциональной присадки для бензинов Полимеры. Применение
Полимеры. Применение Предельные углеводороды. Урок №4
Предельные углеводороды. Урок №4 Химическое равновесие
Химическое равновесие Алгоритм названия органического соединения
Алгоритм названия органического соединения Адсорбция на границе раствор-газ. ПАВ и ПНАВ
Адсорбция на границе раствор-газ. ПАВ и ПНАВ