Содержание
- 2. ТЕМА УРОКА: «Химические свойства алканов» Цели урока: На основе представлений о составе и строении молекул, природе
- 3. CnH2n+2 Химическая устойчивость алканов объясняется высокой прочностью б - связей С-С и С-Н, а также их
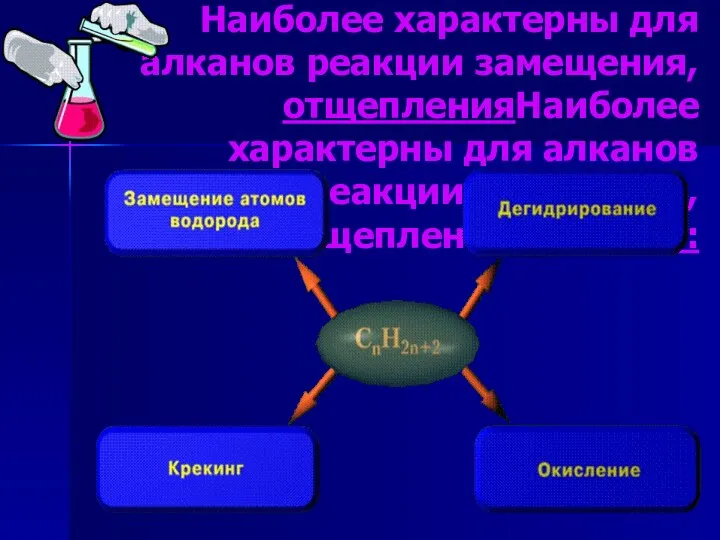
- 4. Наиболее характерны для алканов реакции замещения, Наиболее характерны для алканов реакции замещения, отщепленияНаиболее характерны для алканов
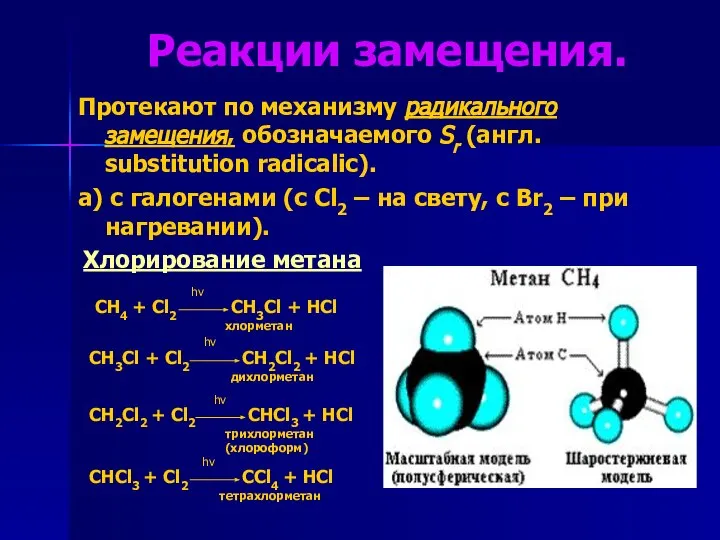
- 5. Реакции замещения. Протекают по механизму радикального замещения, обозначаемого Sr (англ. substitution radicalic). а) с галогенами (с
- 6. Механизм реакции замещения Состоит из 3 стадий: -зарождение цепи Cl2 2Cl· -развитие цепи CH4 + Cl·
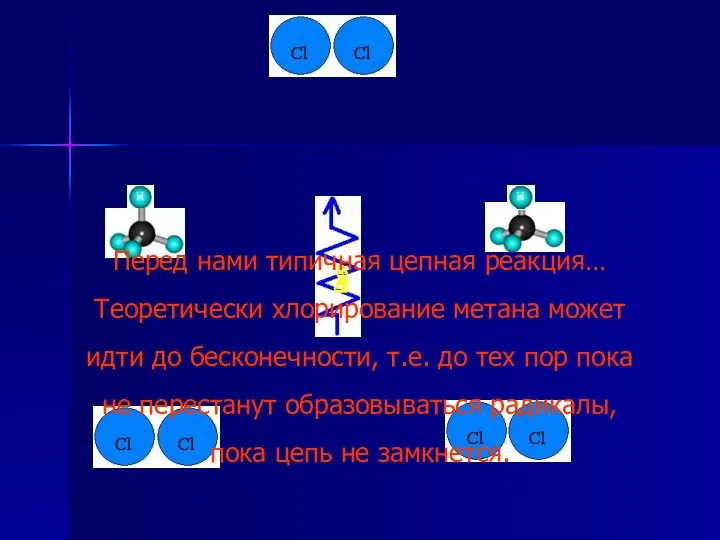
- 7. Перед нами типичная цепная реакция… Теоретически хлорирование метана может идти до бесконечности, т.е. до тех пор
- 8. Общая схема реакции Sr * Замещение у хлорметана идет легче, чем у метана, так как атом
- 9. Взаимодействие со фтором в) в атмосфере фтора происходит следующая реакция:
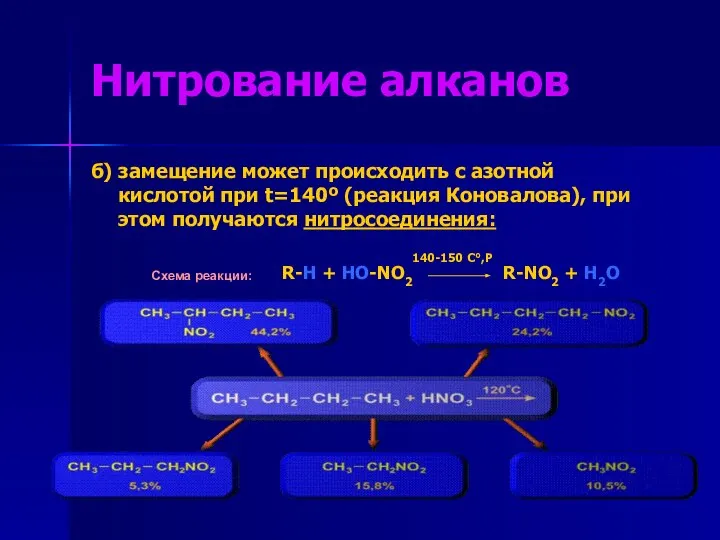
- 10. Нитрование алканов б) замещение может происходить с азотной кислотой при t=140º (реакция Коновалова), при этом получаются
- 11. Реакции отщепления. а) дегидрирование: CH3 – CH3 Pt,t° CH2=CH2 + H2 б) крекинг алканов: CH3 –
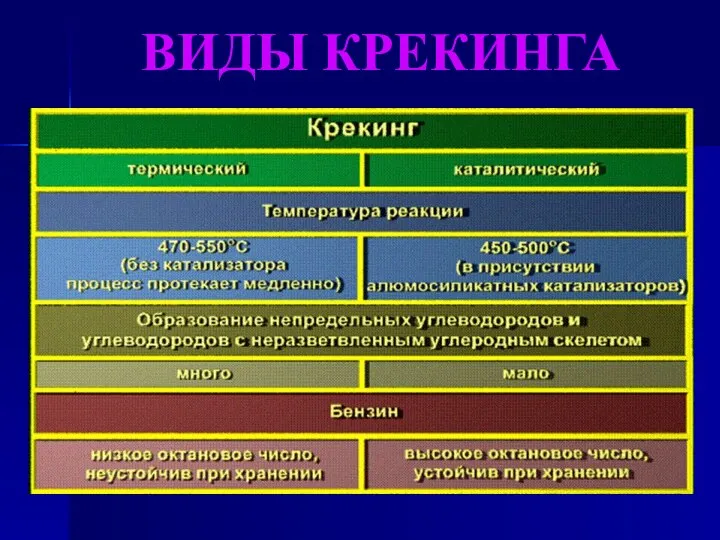
- 12. Крекинг алканов Крекинг – реакции расщепления углеродного скелета крупных молекул при нагревании и в присутствии катализаторов.
- 13. ВИДЫ КРЕКИНГА
- 14. Реакции окисления. а) все алканы горят с образованием углекислого газа и воды : б) при недостатке
- 15. Горение алканов:
- 16. Взрыв метана с кислородом Для полного сгорания метана на один объем метана нужно взять два объема
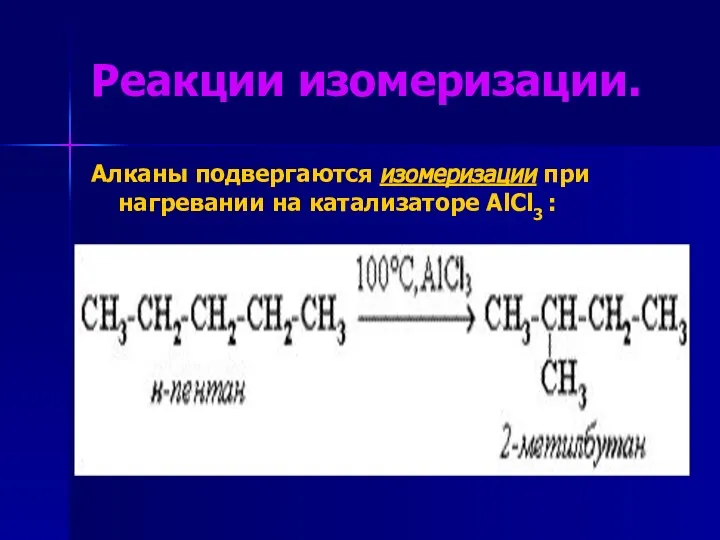
- 17. Реакции изомеризации. Алканы подвергаются изомеризации при нагревании на катализаторе AlCl3 :
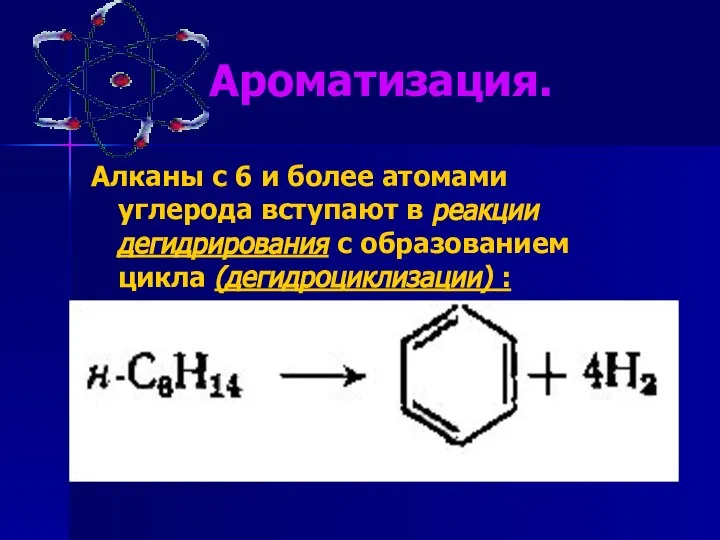
- 18. Ароматизация. Алканы с 6 и более атомами углерода вступают в реакции дегидрирования с образованием цикла (дегидроциклизации)
- 20. Скачать презентацию










 Сложные эфиры. Жиры
Сложные эфиры. Жиры Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук.
Элементы и атомы, В менделеевский взяты круг Сделали химию самой богатой И самой творческой из наук. Алифатические и ароматические амины
Алифатические и ароматические амины Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г.
Урок по теме Алюминий .Строение.Свойства. Учитель: Деревянко Н.Г. Химия – это наука о …
Химия – это наука о … Нефть. Её состав. Термический и каталитический крекинг
Нефть. Её состав. Термический и каталитический крекинг Характеристика кислорода как химического элемента и простого вещества
Характеристика кислорода как химического элемента и простого вещества Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Основные классы неорганических веществ
Основные классы неорганических веществ 11 типы связей
11 типы связей Карбораны. Особенности строения молекулы. Получение и химические свойства
Карбораны. Особенности строения молекулы. Получение и химические свойства Вдоль по радуге
Вдоль по радуге Химия и искусство: техника офорт
Химия и искусство: техника офорт Нефть и основные продукты её переработки
Нефть и основные продукты её переработки Классификация неорганических веществ
Классификация неорганических веществ Свойства воды в твердом и жидком состоянии
Свойства воды в твердом и жидком состоянии Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Классификация и номенклатура неорганических соединений
Классификация и номенклатура неорганических соединений Нуклеиновые кислоты (НК)
Нуклеиновые кислоты (НК) Строение органических молекул. (Лекция 2)
Строение органических молекул. (Лекция 2) Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул Тест по химии
Тест по химии Путешествие в мир кислот
Путешествие в мир кислот Соединения азота
Соединения азота Сложные эфиры. Жиры
Сложные эфиры. Жиры Кремнийорганическая гипотеза
Кремнийорганическая гипотеза Алюминий и сплавы алюминия
Алюминий и сплавы алюминия Металлы и их соединения
Металлы и их соединения