Слайд 2
Для слабых электролитов:
-константа электролитической диссоциации
Для кислот- константа кислотности
Для основания- константа основности

Слайд 3 pH-водородный показатель
pOH-гидроксильный показатель
Для кислот: Для оснований:
- cиловой показатель слабой кислоты

-cиловой показатель слабого основания
Слайд 4Пример 1. Определите концентрацию ионов и рН раствора кислоты муравьиной , для

которой константа электролитической диссоциации
,а степень диссоциации % .
Дано:
%
Найти:
рН-?
Cm( )-?
Слайд 5Решение:
Согласно закону разбавления Оствальда:

Слайд 6Подставим полученные данные в формулу для определения pH:
Ответ:

Слайд 7Пример 2. Определите молярную концентрацию раствора кислоты уксусной, в котором кислотность соответствует

рН = 5,2. Константа диссоциации кислоты (
Дано:
рН = 5,2
Найти:
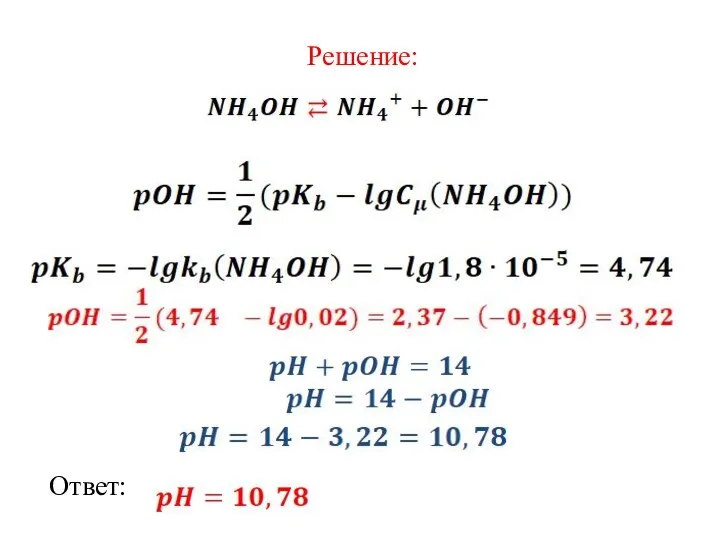
Слайд 10Пример 3. Определите рН раствора аммония гидроксида с концентрацией 0,02 M. Константа

диссоциации слабого основания
Дано:
Найти:
pH-?
Слайд 12Пример 8. Определите рН раствора кислоты уксусной с концентрацией 0,01 г/л. Константа

диссоциации кислоты
Дано:
Найти:
рН-?










 Горный хрусталь
Горный хрусталь Основания. Равновесия в растворах
Основания. Равновесия в растворах Спирты и их производные
Спирты и их производные Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Уретановый каучук
Уретановый каучук Сера и ее соединения
Сера и ее соединения Интерактивная интеллектуальная игра. Юный химик
Интерактивная интеллектуальная игра. Юный химик Минералы
Минералы Кислоты. Состав кислот, их классификация и физические свойства, 8 класс
Кислоты. Состав кислот, их классификация и физические свойства, 8 класс Дизайн молекулярных магнетиков
Дизайн молекулярных магнетиков Диспропроциялану реакциялары
Диспропроциялану реакциялары Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Молибден. Получение молибдена
Молибден. Получение молибдена Галогены и их соединения
Галогены и их соединения Аминоксилоты. Общая формула аминокислот
Аминоксилоты. Общая формула аминокислот Презентация на тему Щелочные металлы
Презентация на тему Щелочные металлы  Презентация на тему Лекарства
Презентация на тему Лекарства  Общие свойства растворов
Общие свойства растворов Галогениды, нитраты и сульфаты лантаноидов
Галогениды, нитраты и сульфаты лантаноидов Вклад Д.И. Менделеева в науку
Вклад Д.И. Менделеева в науку Упражнения. Масс-спектрометрия
Упражнения. Масс-спектрометрия Межмолекулярные взаимодействия (лекция 4)
Межмолекулярные взаимодействия (лекция 4) Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны
Производственно-торговая компания ООО СОЖ Синтез-Набережные Челны Жаропрочные и жаростойкие стали
Жаропрочные и жаростойкие стали Презентация на тему Химические свойства алкенов
Презентация на тему Химические свойства алкенов  Скорость химической реакции. 9 класс
Скорость химической реакции. 9 класс Относительная атомная масса
Относительная атомная масса Презентация на тему Строение газообразных, жидких и твердых тел
Презентация на тему Строение газообразных, жидких и твердых тел