Содержание
- 2. Степень окисления Определяется количеством электронов, которое может отдавать или принимать элемент, вступая в соединение Условный заряд
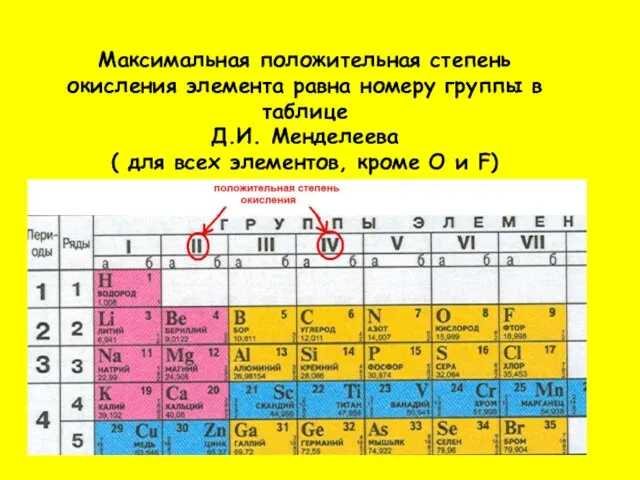
- 3. Максимальная положительная степень окисления элемента равна номеру группы в таблице Д.И. Менделеева ( для всех элементов,
- 4. ЗАДАНИЕ 1. Определить положительные степени окисления элементов: Al Zn O Mg Si P Li N Cl
- 5. Отрицательную степень окисления могут проявлять только неметаллы. Отрицательная степень окисления = № группы - 8 ЗАДАНИЕ
- 6. Бинарное соединение - вещество, состоящее из 2 химических элементов.
- 7. На первом месте в формуле принято писать элемент с положительной степенью окисления, на последнем месте –
- 8. На первое место в формуле ставится элемент, номер группы которого меньше ЗАДАНИЕ 4. Составить формулы веществ,
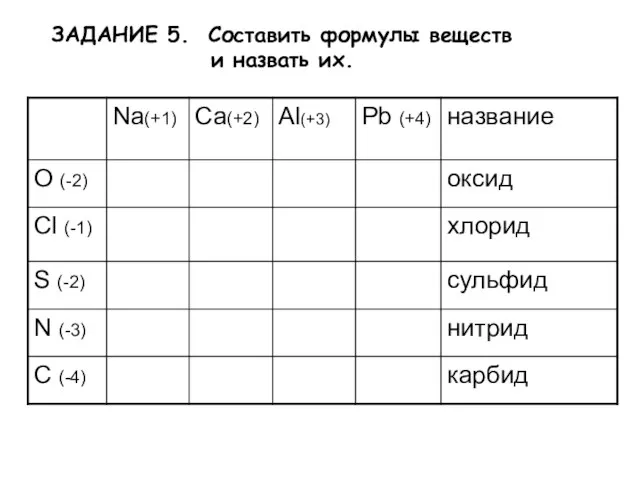
- 9. ЗАДАНИЕ 5. Cоставить формулы веществ и назвать их.
- 10. Названия бинарных соединений На втором месте в формуле: Cl – хлорид O – оксид S –
- 11. Некоторые элементы могут проявлять несколько положительных степеней окисления. Например, медь Cu - +1 и +2, сера
- 12. ЗАДАНИЕ 7. Составить формулы бинарных соединений Хлорид цинка Оксид кремния Нитрид натрия Бромид алюминия Карбид бария
- 14. Скачать презентацию









 Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Презентация на тему Получение галогенов. Биологическое значение и применение галогенов
Презентация на тему Получение галогенов. Биологическое значение и применение галогенов  Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли
Презентация на тему Изучение реакции среды в зависимости от типа гидролиза соли  Пултаруллă
Пултаруллă Степени окисления химических элементов в соединениях
Степени окисления химических элементов в соединениях Исследование кокаина методом ГХ-МС
Исследование кокаина методом ГХ-МС Алканы: состав, строение, изомерия, номенклатура, получение
Алканы: состав, строение, изомерия, номенклатура, получение Алканы
Алканы Молярный объем газов
Молярный объем газов Химия неорганическая и органическая
Химия неорганическая и органическая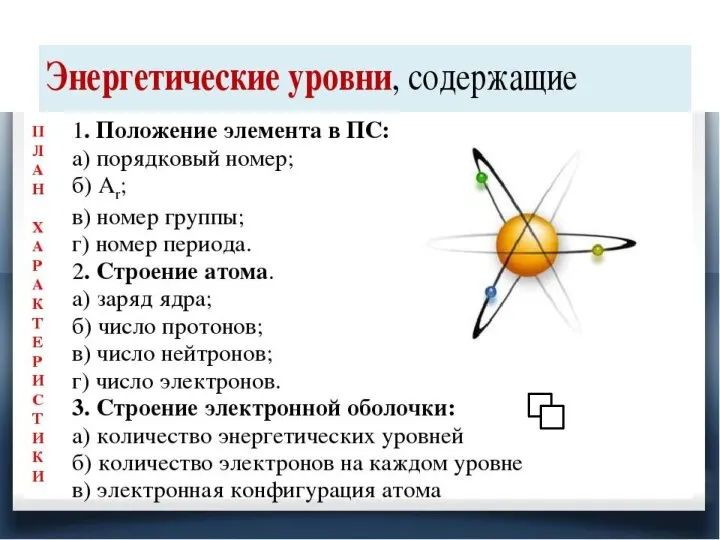 Закономерности изменения свойств атомов химических элементов
Закономерности изменения свойств атомов химических элементов Лекция 10. Неорганическая химия. Сероводород
Лекция 10. Неорганическая химия. Сероводород Условия преобразования органических веществ
Условия преобразования органических веществ Сплавы. 9 класс
Сплавы. 9 класс Семь доисторических металлов
Семь доисторических металлов Получение алканов
Получение алканов Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Презентация на тему Сведения о воде
Презентация на тему Сведения о воде  Кислоты
Кислоты Классификация реагентов и реакций в органической химии. (Лекция 4)
Классификация реагентов и реакций в органической химии. (Лекция 4) Personal сare. Akypo Foam Rl 40
Personal сare. Akypo Foam Rl 40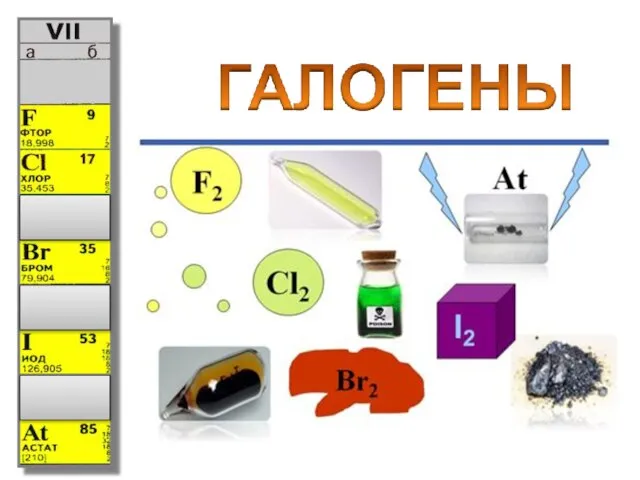 Общая характеристика элементов VIIa группы
Общая характеристика элементов VIIa группы Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению
Гидролиз – это обменное взаимодействие веществ с водой, приводящее к их разложению Общие знания по курсу неорганической химии
Общие знания по курсу неорганической химии Закон сохранения массы и химические уравнения
Закон сохранения массы и химические уравнения Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Щелочные металлы
Щелочные металлы Степень окисления
Степень окисления