Содержание
- 2. Аллотро́пия (от др.-греч. αλλος — «другой», τροπος — «поворот, свойство») — существование двух и более простых
- 4. фосфор Фо́сфор — химический элемент 15-й группы (по устаревшей классификации — главной подгруппы пятой группы) третьего
- 5. Белый, красный, черный и металлический фосфор .
- 6. Белый фосфор Белый фосфор представляет собой белое вещество . По внешнему виду он очень похож на
- 7. Красный фосфор Красный фосфор — это более термодинамически стабильная модификация элементарного фосфора. Впервые он был получен
- 8. Черный фосфор Чёрный фосфор — это наиболее стабильная термодинамически и химически наименее активная форма элементарного фосфора.
- 9. Металлический фосфор При 8,3·1010 Па чёрный фосфор переходит в новую, ещё более плотную и инертную металлическую
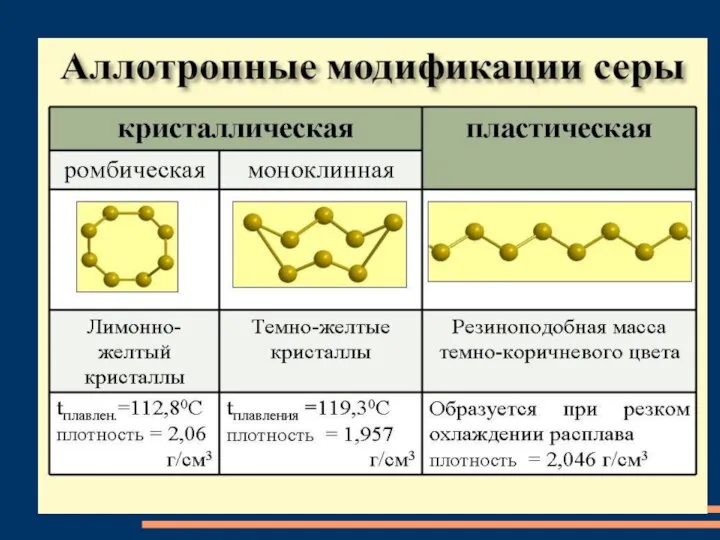
- 10. сера Се́ра — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), третьего периода
- 12. кислород Кислоро́д — элемент 16-й группы (по устаревшей классификации — главной подгруппы VI группы), второго периода
- 14. углерод Углерод — вещество с самым большим числом аллотропических модификаций (более 8 уже обнаружены). Аллотропные модификации
- 19. кремний Кре́мний — элемент главной подгруппы четвёртой группы третьего периода периодической системы химических элементов Д. И.
- 21. Скачать презентацию

















 Алкены (олефины)
Алкены (олефины) Свойства ртути
Свойства ртути Химические свойства классов неорганических соединений
Химические свойства классов неорганических соединений Кристаллы. Формирование кристаллов
Кристаллы. Формирование кристаллов Соли. Химические свойства
Соли. Химические свойства Аллотропия
Аллотропия Валентность, классы и номенклатура неорганических веществ
Валентность, классы и номенклатура неорганических веществ Особенности базового курса органической химии издательства «ОЛМА»
Особенности базового курса органической химии издательства «ОЛМА» Обобщение знаний об углеводородах
Обобщение знаний об углеводородах Химический состав живых организмов. Метаболизм
Химический состав живых организмов. Метаболизм Проект Chemical 3D
Проект Chemical 3D Алкены
Алкены Азот
Азот Понятия и законы в химии. (Лекция 1)
Понятия и законы в химии. (Лекция 1) Химическая связь
Химическая связь Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса
Что такое углеволокно (карбон) и как оно может спасти нас от нефтяного кризиса Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность
Комплексы хлорида и иодида цинка (II) с карбамидом: синтез, характеристика и биологическая активность Особенные свойства муравьиной кислоты
Особенные свойства муравьиной кислоты Окислительно-восстановительные процессы
Окислительно-восстановительные процессы Переработка нефти. 10 класс
Переработка нефти. 10 класс Окситоцин. Сила любви и биология
Окситоцин. Сила любви и биология Молярный объем
Молярный объем Бутан как хладагент
Бутан как хладагент Галогены
Галогены Тефлон
Тефлон Презентация на тему Эфирные масла
Презентация на тему Эфирные масла  ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области
ЭТА УВЛЕКАТЕЛЬНАЯ ХИМИЯ… Первый урок химии в 8 классе Абрамова С.И., учитель химии МОУ «Лихославльская СОШ №2» Тверской области Окислительно-восстановительные реакции
Окислительно-восстановительные реакции