Содержание
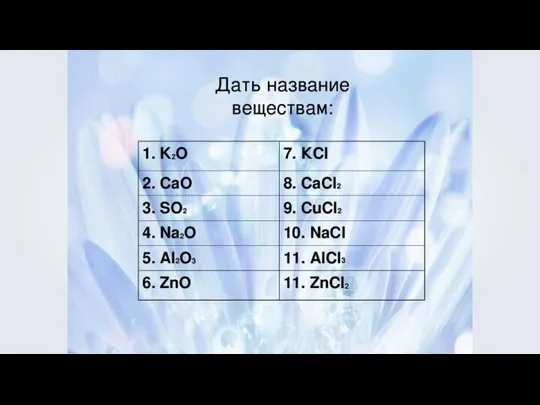
- 2. O 2 Cl 2 Сложное вещество — это вещество, состоящее из атомов разных химических элементов.
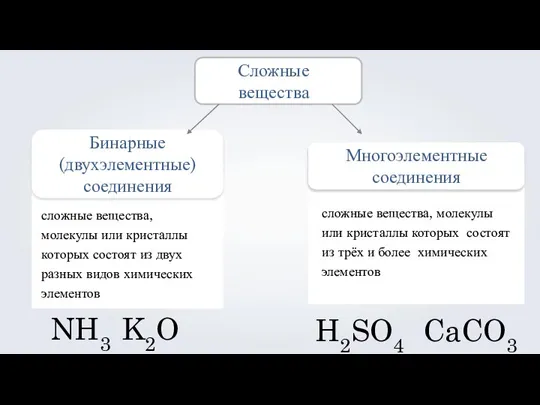
- 3. Сложные вещества Бинарные (двухэлементные) соединения сложные вещества, молекулы или кристаллы которых состоят из двух разных видов
- 4. Бинарные вещества NaCl CO2 H2O
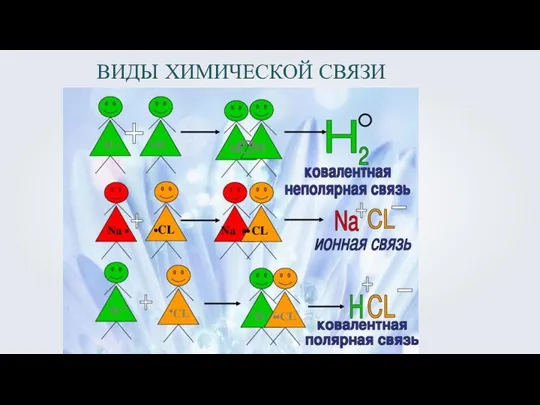
- 5. ВИДЫ ХИМИЧЕСКОЙ СВЯЗИ
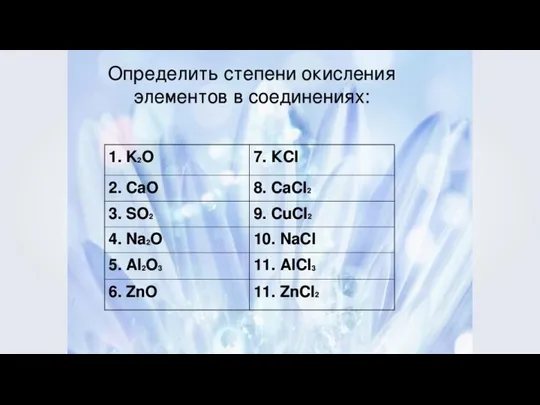
- 6. Степень окисления — это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что
- 9. Определение степеней окисления 1. У металлов IА группы таблицы Менделеева во всех соединениях степень окисления равна
- 10. Определение степеней окисления 2. У металлов IIА группы таблицы Менделеева во всех соединениях степень окисления равна
- 11. Определение степеней окисления 3. У металлов IIIА группы таблицы Менделеева во всех соединениях степень окисления равна
- 12. Определение степеней окисления 4. Водород в соединениях имеет степень окисления +1. H2O H3N +1 –1 +1
- 13. Определение степеней окисления 5. Нулевое значение степени окисления имеют атомы в молекулах простых веществ и атомы
- 14. Исключения в пероксидах -1
- 18. +3 -2 FeS Запишем знаки железа и серы рядом. Железо как менее элекроотрицательный элемент становится на
- 19. Названия бинарных соединений Первое слово указывает на электроотрицательную часть соединения, к нему прибавляется окончание –ид в
- 20. Названия бинарных соединений SiO2 — оксид кремния NO — оксид азота (II) Пример 2. Если менее
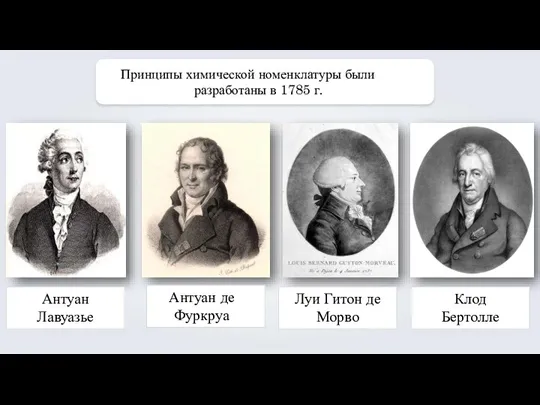
- 22. Антуан Лавуазье Антуан де Фуркруа Луи Гитон де Морво Клод Бертолле Принципы химической номенклатуры были разработаны
- 26. Скачать презентацию


















 Амины. Аминокислоты
Амины. Аминокислоты Спирты или алканолы
Спирты или алканолы Ліпіди
Ліпіди Презентация по Химии "Строение и физические свойства металлов"
Презентация по Химии "Строение и физические свойства металлов"  Валентность
Валентность Структура и свойства чистого титана
Структура и свойства чистого титана Получение и применение алканов (10 класс)
Получение и применение алканов (10 класс) Презентация на тему Соединения серы
Презентация на тему Соединения серы  Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр
Кальций в океане: кораллы и жемчуг. Кальций в строительстве: гипс и алебастр ОВР
ОВР Презентация на тему Альдегиды, свойства, получение, применение
Презентация на тему Альдегиды, свойства, получение, применение  Центробежное осаждение
Центробежное осаждение Периодическая система химических элементов Д.И. Менделеева
Периодическая система химических элементов Д.И. Менделеева Теория валентных связей
Теория валентных связей Положительно (+) заряженные частицы. Катионы
Положительно (+) заряженные частицы. Катионы Периодическая система химических элементов. Периоды. Группы
Периодическая система химических элементов. Периоды. Группы Презентация на тему Альдегиды (10 класс)
Презентация на тему Альдегиды (10 класс)  Презентация на тему Классификация химических реакций
Презентация на тему Классификация химических реакций  Закон сохранения массы. 11 класс
Закон сохранения массы. 11 класс Гидрокрекинг нефтяного сырья
Гидрокрекинг нефтяного сырья Оксиды углерода
Оксиды углерода Жиры. Строение жиров
Жиры. Строение жиров Производство полимеров в РК
Производство полимеров в РК теория строения
теория строения Магнитный момент атома. Периодическая система элементов Д.И. Менделеева
Магнитный момент атома. Периодическая система элементов Д.И. Менделеева Лекция1Тов
Лекция1Тов Типы химических реакций в органической химии
Типы химических реакций в органической химии Атомы, молекулы и ионы
Атомы, молекулы и ионы