Слайд 2Физические свойства
При обычных условиях концентрированная серная кислота — тяжёлая маслянистая жидкость без цвета

и запаха. При растворении её в воде происходит очень сильное разогревание.
Слайд 3 Разбавленная серная кислота обладает общими свойствами, характерными для всех кислот.

Слайд 4Водный раствор изменяет окраску индикаторов :
- лакмус - красный,
- метилоранж - красный,
-

фенолфталеин - не изменяет своей окраски.
Слайд 5Разбавленная серная кислота реагирует с металлами, стоящими в ряду активности металлов до

водорода:
H2SO4+Zn=ZnSO4+H2
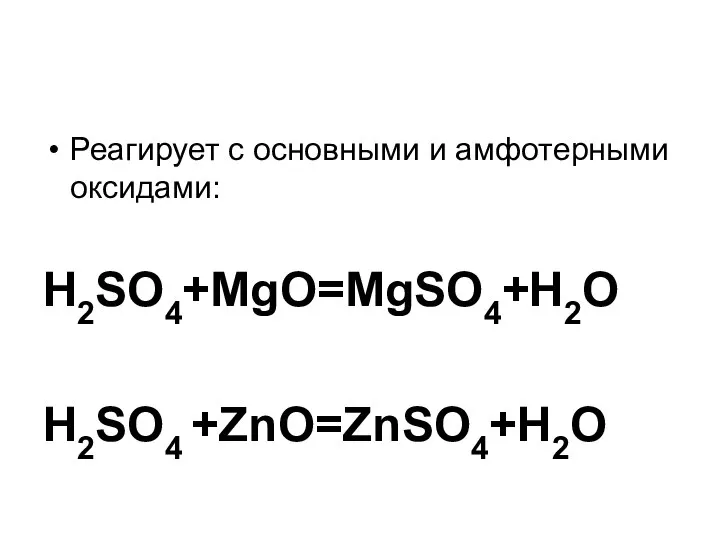
Слайд 6Реагирует с основными и амфотерными оксидами:
H2SO4+MgO=MgSO4+H2O
H2SO4 +ZnO=ZnSO4+H2O
Слайд 7Взаимодействует с основаниями:
H2SO4+2KOH=K2SO4+2H2O

Слайд 8Если кислота взята в избытке, то образуется кислая соль:
H2SO4+NaOH=NaHSO4+H2O

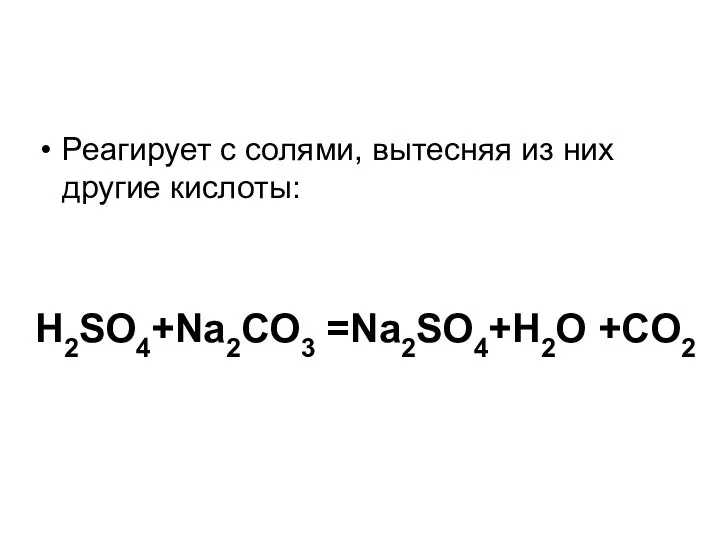
Слайд 9Реагирует с солями, вытесняя из них другие кислоты:
H2SO4+Na2CO3 =Na2SO4+H2O +CO2
Слайд 10 Свойства
концентрированной
серной кислоты

Слайд 11Концентрированная серная кислота энергично реагирует с водой с образованием гидратов:
H2SO4+nH2O=H2SO4·nH2O+Q

Слайд 12-при нагревании она реагирует со всеми металлами ( исключение Au, Pt и

нек. др.). В этих реакциях в зависимости от активности металла и условий выделяются SO2, H2S, S.
Слайд 13Взаимодействие концентрированной серной кислоты с металлами:
H2SO4 + МЕ0 = соль-сульфат + H2O
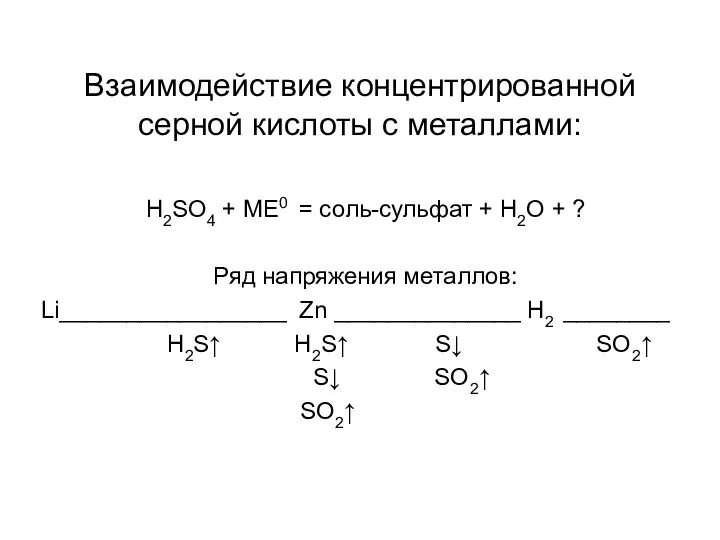
+ ?
Ряд напряжения металлов:
Li_________________ Zn ______________ H2 ________
H2S↑ H2S↑ S↓ SO2↑
S↓ SO2↑
SO2↑
Слайд 14Характерной реакцией на серную кислоту и её соли является взаимодействие с растворимыми

солями бария:
H2SO4+BaCl2=BaSO4↓+2HCl
Выпадает белый осадок, который не растворяется ни в воде, ни в концентрированной азотной кислоте
Слайд 15Применение серной кислоты
в производстве минеральных удобрений;
как электролит в свинцовых аккумуляторах;
для

получения различных минеральных кислот и солей;
в производстве химических волокон, красителей, дымообразующих веществ и взрывчатых веществ;
в нефтяной, металлообрабатывающей, текстильной, кожевенной и др. отраслях промышленности;
в пищевой промышленности — зарегистрирована в качестве пищевой добавки E513(эмульгатор);
в промышленном органическом синтезе.














 Клуб юных химиков. Школа №3
Клуб юных химиков. Школа №3 Анализ образца доломита методами аналитической химии
Анализ образца доломита методами аналитической химии Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя
Гипертекст как средство развития познавательной активности учащихся на уроках химии Синицына Елена Александровна МОУ «Средняя  Получение алканов
Получение алканов Практика по химии
Практика по химии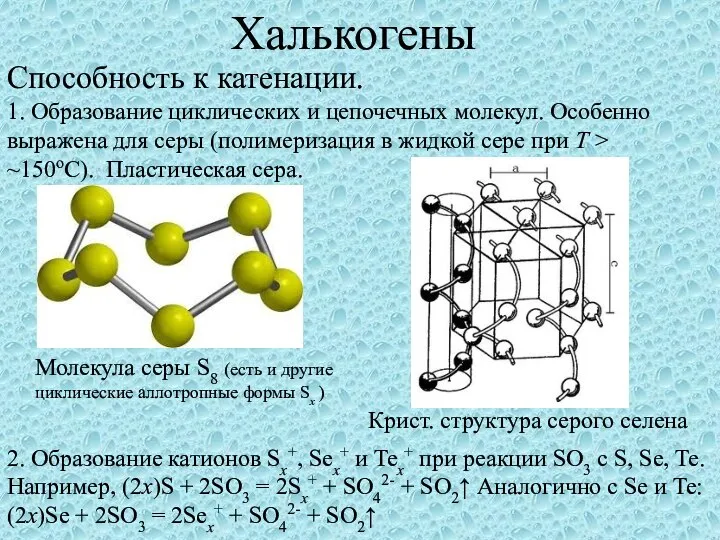 Халькогены. Способность к катенации
Халькогены. Способность к катенации Массовая доля химического элемента
Массовая доля химического элемента Щелочноземельные металлы
Щелочноземельные металлы Презентация по Химии "Быль о каучуке"
Презентация по Химии "Быль о каучуке"  Галогеналканы и реакции отщепления
Галогеналканы и реакции отщепления Соли: получение
Соли: получение Химия на войне
Химия на войне Кислород – это самый распространенный на нашей планете элемент
Кислород – это самый распространенный на нашей планете элемент карбоновые кислоты
карбоновые кислоты Современное представление о строении атома, S- и P- орбитали
Современное представление о строении атома, S- и P- орбитали Окислители в пиросоставах
Окислители в пиросоставах Презентация на тему Химические свойства оксидов
Презентация на тему Химические свойства оксидов  Применение серы, хлора, углерода
Применение серы, хлора, углерода Массовая доля химич элемента
Массовая доля химич элемента Фенол
Фенол Углеводы
Углеводы Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа
Решение задач на примере работы реакторов для реализации гетерогенных некаталитических процессов. Практическая работа Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс)
Технологии получения и преобразования текстильных материалов. Синтетические волокна (9 класс) Алкины
Алкины Кислотно-основные взаимодействия
Кислотно-основные взаимодействия Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Ковалентная связь между одинаковыми атомами неметаллов
Ковалентная связь между одинаковыми атомами неметаллов Морфологогия минералов
Морфологогия минералов