Содержание
- 2. Кислоты- сложные вещества, которые состоят из атомов водорода, способных замещаться на Ме, и кислотного остатка. Существует
- 3. 1 способ: наличие кислорода Кислоты Бескислородные Кислородсодержащие НCl-соляная НBr-бромоводородная H2S-сероводородная HF-плавиковая Н2SO4-серная Н2SiO3-кремниевая Н2СO3-угольная HNO3-азотная НClO4-хлорная
- 4. Бескислородные кислоты Это водные растворы летучих водородных соединений неметаллов. Расчет валентности, степени окисления и вывод структурной
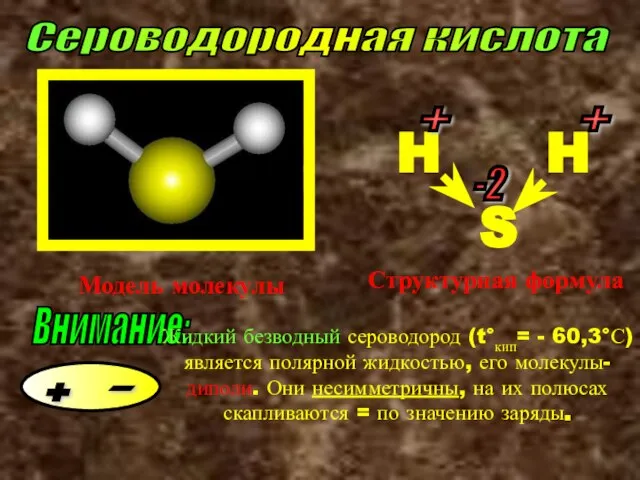
- 5. Сероводородная кислота Модель молекулы S H H + + -2 Структурная формула Внимание: Жидкий безводный сероводород
- 6. Наиболее важные бескислородные кислоты Выучить наизусть! HCl-соляная( хлороводородная ) HF-плавиковая( фтороводородная ) HBr- бромоводородная HI- иодоводородная
- 7. Кислородсодержащие кислоты Эти вещества имеют кислотный остаток- сложный анион, который состоит из атомов кислорода со степенью
- 8. Запомни! Следует различать степень окисления отдельных элементов и всего сложного иона в целом. Задача: найти степени
- 9. (+1)*2+Х+(-2)*4=0 2+Х=8→Х=+6 Центральный элемент может быть атомом неметалла или атомом металла из побочной подгруппы с большой
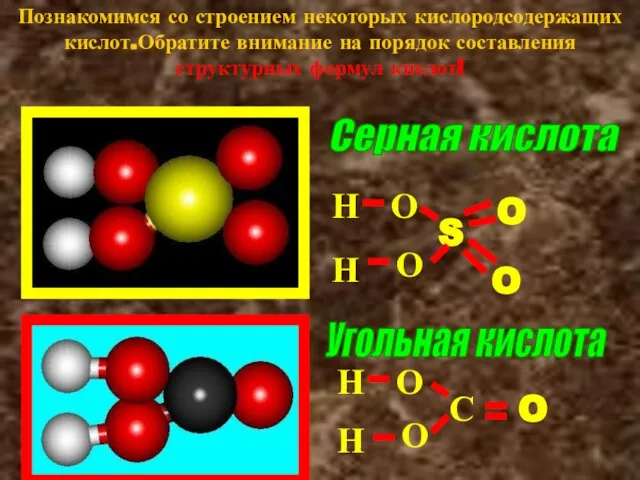
- 10. Познакомимся со строением некоторых кислородсодержащих кислот.Обратите внимание на порядок составления структурных формул кислот! Серная кислота Угольная
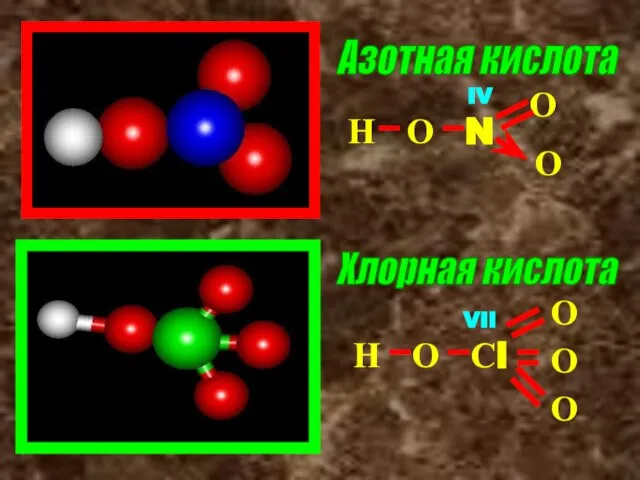
- 11. Азотная кислота Хлорная кислота Н О N О О Н О Сl О О О IV
- 12. Эй, придется и эти названия выучить! H2SO4-серная H2СO3-угольная HNO3-азотная H2SiO3-кремниевая HNO2-азотистая H2SO3-сернистая H3РO4-фосфорная HClO4-хлорная
- 13. 2 способ: основность кислоты Кислоты Одноосновные Многоосновные Под основностью кислоты подразумевается число атомов водорода, способных замещаться
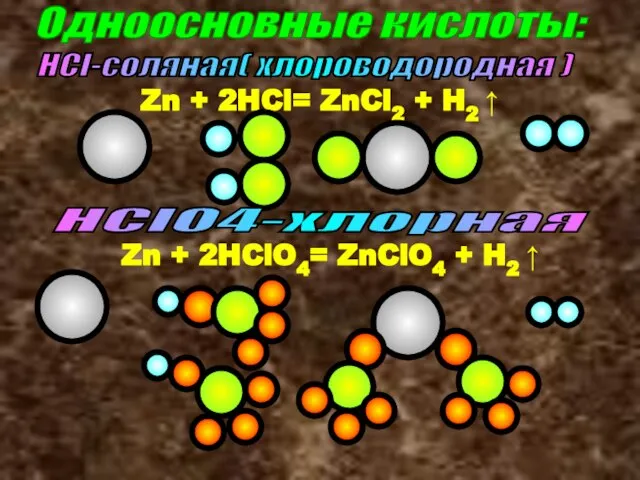
- 14. Одноосновные кислоты: HCl-соляная( хлороводородная ) Zn + 2HCl= ZnCl2 + H2 ↑ Zn + 2HClO4= ZnClO4
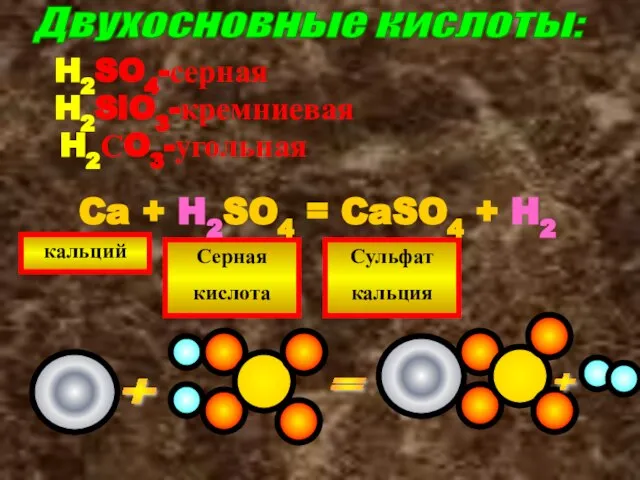
- 15. Двухосновные кислоты: H2SO4-серная H2SiO3-кремниевая H2СO3-угольная Ca + H2SO4 = CaSO4 + H2 кальций Серная кислота Сульфат
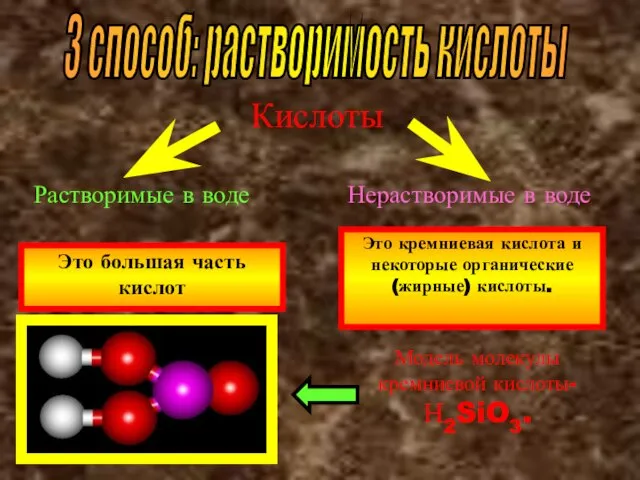
- 16. 3 способ: растворимость кислоты Кислоты Растворимые в воде Нерастворимые в воде Это большая часть кислот Это
- 17. 4 способ: летучесть кислоты Кислоты летучие нелетучие HCl, H2S, HBr, уксусная кислота Н2SO4, H2SiO3,высшие жирные кислоты
- 18. Концентрированная соляная кислота (подкрашенная). Молекулы газа хлороводорода над поверхностью раствора соляной кислоты. Концентрированная сероводородная кислота .
- 19. Концентрированные растворы нелетучих кислот не переходят в газообразное состояние. 5 способ: сила кислоты Кислоты сильные слабые
- 20. Диссоциация кислот Согласно теории электролитической диссоциации С.Аррениуса, кислота - это вещество, которое диссоциирует на катионы водорода
- 21. H2SO4→2H+ +SO42- сульфат-анион внимание: При диссоциации кислородсодержащей кислоты надо помнить, что кислотный остаток – единый сложный
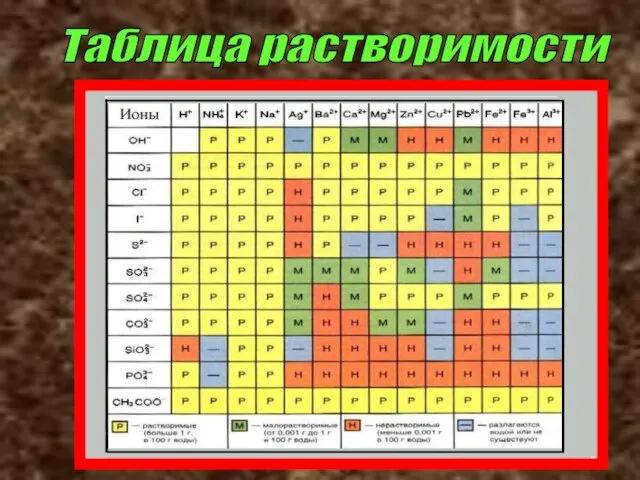
- 22. Таблица растворимости
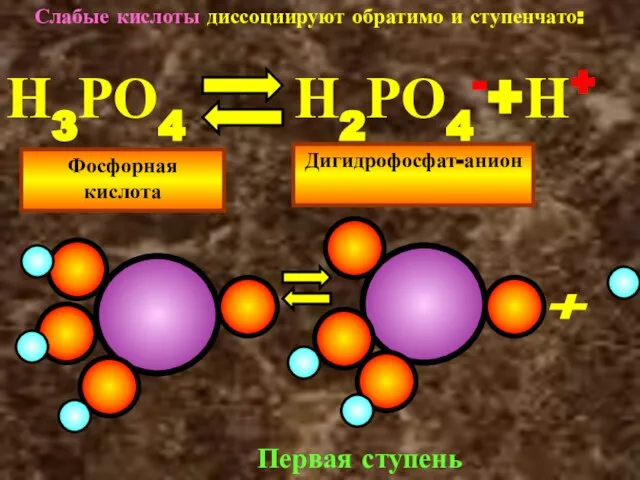
- 23. Слабые кислоты диссоциируют обратимо и ступенчато: Н3РО4 Н2РО4-+Н+ Фосфорная кислота Дигидрофосфат-анион + Первая ступень
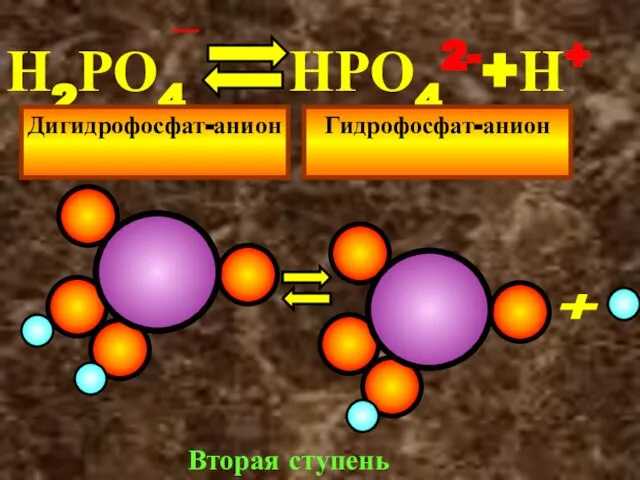
- 24. Н2РО4 НРО42-+Н+ - Дигидрофосфат-анион Гидрофосфат-анион + Вторая ступень
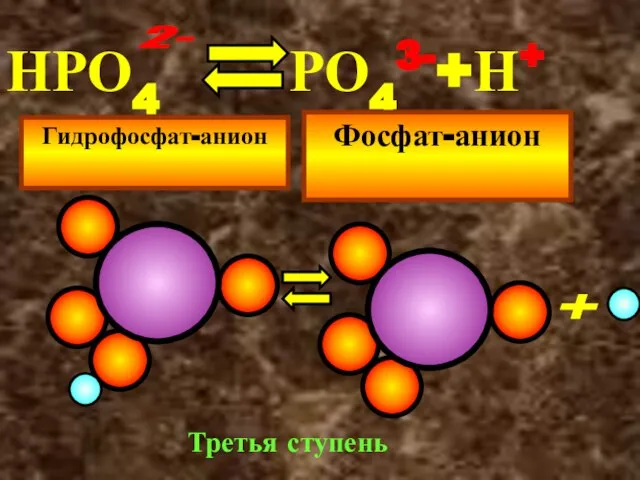
- 25. НРО4 РО43-+Н+ Гидрофосфат-анион Фосфат-анион 2- + Третья ступень
- 26. Катионы Н+ придают растворам кислот кислый вкус и изменяют окраску индикаторов. лакмус метилоранж фенолфталеин Язык чует
- 27. Друзья, а давайте-ка еще выучим стихи про индикаторы! Ах, что же я поделаю с собой- Ведь
- 28. 6 способ: стабильность кислоты Кислоты стабильные нестабильные HCl, HBr, H2SO4, H3PO4 Н2SO3, H2SiO3 H2CO3 Стабильные кислоты
- 29. Нестабильные кислоты с течением времени разлагаются: Н2СО3 = СО2 ↑ +Н2О Угольная кислота Углекислый газ Н2SО3
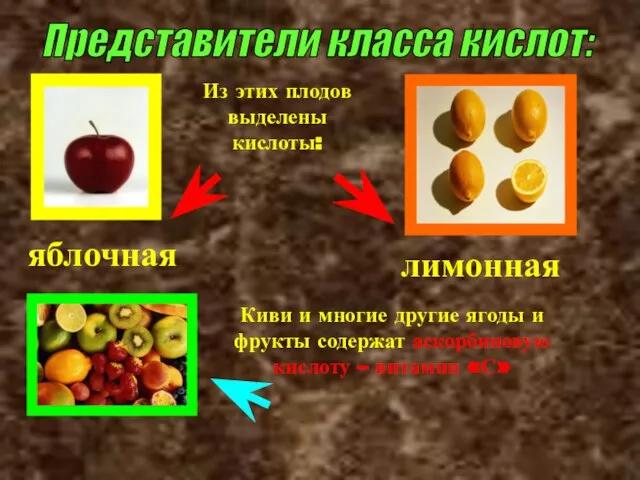
- 30. Представители класса кислот: Из этих плодов выделены кислоты: яблочная лимонная Киви и многие другие ягоды и
- 31. В семенах миндаля иногда встречается сильный яд – синильная кислота. При скисании вина образуется уксусная кислота.
- 32. Промышленно значимые кислоты: H2SO4 - серная HCl - соляная НNO3 - азотная
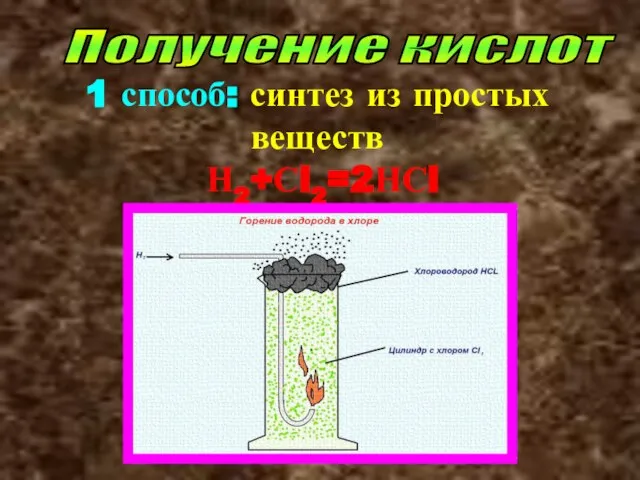
- 33. Получение кислот 1 способ: синтез из простых веществ Н2+Сl2=2НСl
- 34. 2 способ: получение из руды оксидов неметаллов и взаимодействие их с водой. Пирит (серный колчедан) FeS2
- 35. 2 стадия : окисление сернистого газа 2 SO2 + O2 = 2 SO3 t°, Pt Сернистый
- 36. 3 способ: получение оксидов неметаллов другими способами и взаимодействие их с водой. 4NH3 + 5O2 =
- 37. Кислотные оксиды Это такие оксиды, которым соответствуют гидроксиды-кислоты. Степень окисления элемента в оксиде и степень окисления
- 38. SO3 Серный ангидрид( оксид серы(VI))→соответствующая кислота- серная H2SO4 +6 +6 N2O5 HNO3 +5 +5 Азотный ангидрид(
- 39. Mn2O7 Марганцевый ангидрид( оксид марганца(VII))→соответствующая кислота- марганцевая HMnO4 +7 +7 Кислотные оксиды иногда взаимодействуют с водой
- 40. Химические свойства кислот: №1 Реакция нейтрализации Это реакция между любой кислотой и любым основанием, ведущая к
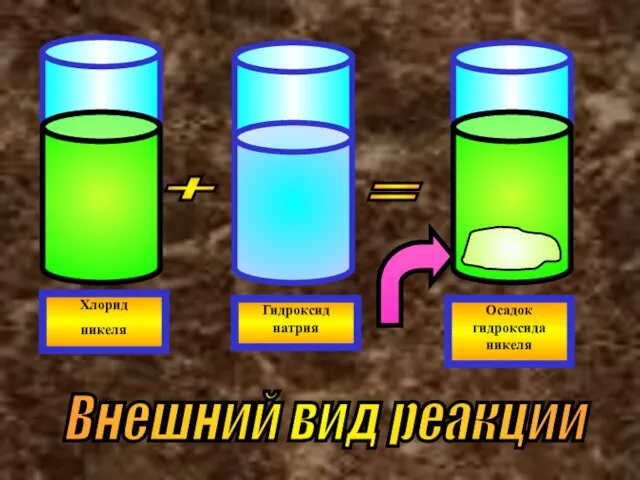
- 41. + = Хлорид никеля Гидроксид натрия Осадок гидроксида никеля Внешний вид реакции
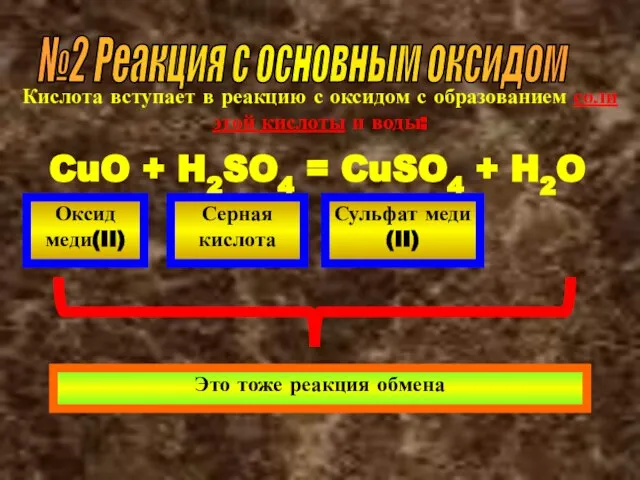
- 42. №2 Реакция с основным оксидом Кислота вступает в реакцию с оксидом с образованием соли этой кислоты
- 43. №3 Реакция с солью Сильная кислота способна вытеснить слабую кислоту из раствора ее соли.Нередко вытесненная кислота
- 44. Na2SiО3+Н2SO4=Н2SiО3↓+Na2SO4 Cиликат натрия Кремниевая кислота (нерастворимая) №4 Реакция с металлом Тут надо учитывать несколько важных факторов:
- 45. Влияние природы металла Нам надо воспользоваться вытеснительным рядом металлов Бекетова. LI K Ba Ca Mg AL
- 46. Реагируют с разбавленными р-рами кислот с выделением водорода и способны вытеснять стоящий правее в ряду Бекетова
- 47. Cu+2H2SO4=CuSO4+SO2↑+H2O концентрированная Сернистый газ Влияние концентрации кислоты Mg+H2SO4=MgSO4+H2↑ Сульфат магния разбавленная Mg+2H2SO4=MgSO4+SO2↑+2H2O Концентрированная, горячая Сульфат магния
- 48. Влияние природы кислоты Запомните, дети, раз и навсегда: Азотная кислота никогда не реагирует с металлами с
- 50. Скачать презентацию

































 Уравнения химических реакций
Уравнения химических реакций Развитие ассоциативного мышления на уроках химии
Развитие ассоциативного мышления на уроках химии Алканы и их свойства
Алканы и их свойства Основные подходы к формированию и развитию социальных компетенций на уроках химии
Основные подходы к формированию и развитию социальных компетенций на уроках химии Химия. Витамин В12
Химия. Витамин В12 Минеральные вещества
Минеральные вещества Свойства воды
Свойства воды Химические явления
Химические явления Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии
Метод высокоэффективной жидкостной хроматографии и тандемной масс-спектрометрии Строение атома. Периодический закон
Строение атома. Периодический закон Презентация на тему Чистые вещества и смеси
Презентация на тему Чистые вещества и смеси  Алифатические соединения. Тема № 6
Алифатические соединения. Тема № 6 Алюминий
Алюминий Донорно-акцепторный механизм образование связи
Донорно-акцепторный механизм образование связи Стратегия обучения решению задач по химии
Стратегия обучения решению задач по химии Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Презентация на тему Роль йода в организме
Презентация на тему Роль йода в организме  Презентация на тему Кальций
Презентация на тему Кальций  Введение в органическую химию
Введение в органическую химию Степень окисления. Бинарные соединения
Степень окисления. Бинарные соединения Электролитическая диссоциация. Урок химии в 8 классе
Электролитическая диссоциация. Урок химии в 8 классе Типы метаморфизма
Типы метаморфизма Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Презентация на тему Жизнь Д.И.Менделеева
Презентация на тему Жизнь Д.И.Менделеева  Поликарбонат мономерлері
Поликарбонат мономерлері Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А.
Удивительные кристаллы Выполнена учеником 8 а класса Савиным Анатолием Учитель: Звёздочкина С.А. Углерод
Углерод