Содержание
- 2. Коллоидная химия Т. Грэм, 1861г Коллоидами Грэм назвал вещества, которые образуют водные растворы с клееподобными свойствами
- 3. Коллоидная химия Т. Грэм, 1861г коллоидное состояние вещества - состояние материи, промежуточное между молекулярным состоянием (атомы,
- 4. Современная коллоидная химия –область химической науки, изучающая свойства веществ в дисперсном состоянии и поверхностные явления в
- 5. Коллоидная химия В геометрии Поверхность имеет площадь, но не имеет толщины. Это общая часть двух смежных
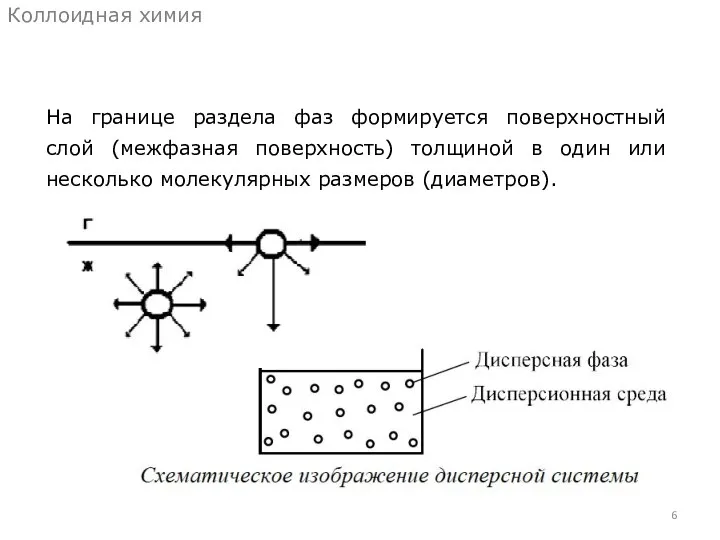
- 6. На границе раздела фаз формируется поверхностный слой (межфазная поверхность) толщиной в один или несколько молекулярных размеров
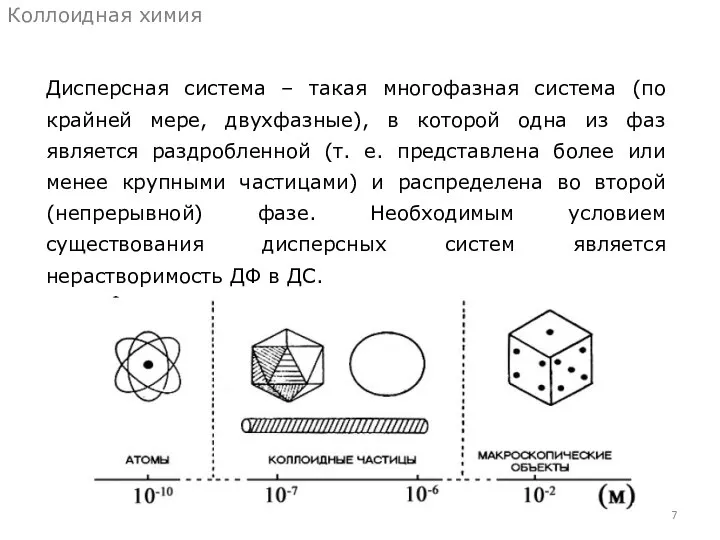
- 7. Дисперсная система – такая многофазная система (по крайней мере, двухфазные), в которой одна из фаз является
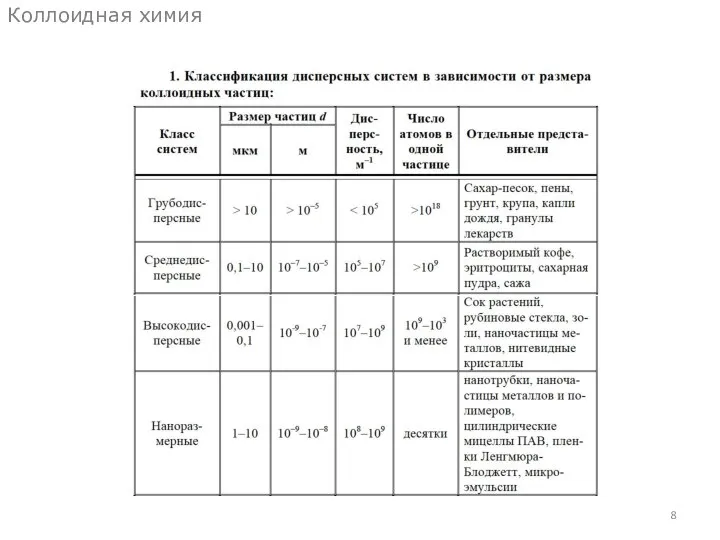
- 8. Коллоидная химия
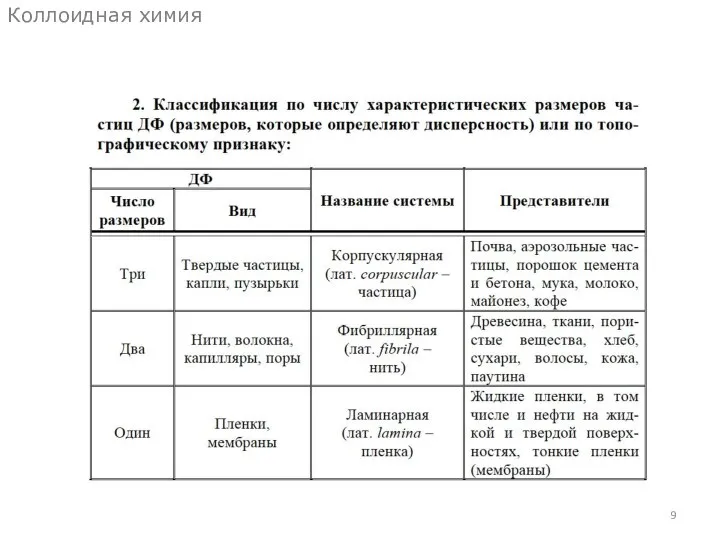
- 9. Коллоидная химия
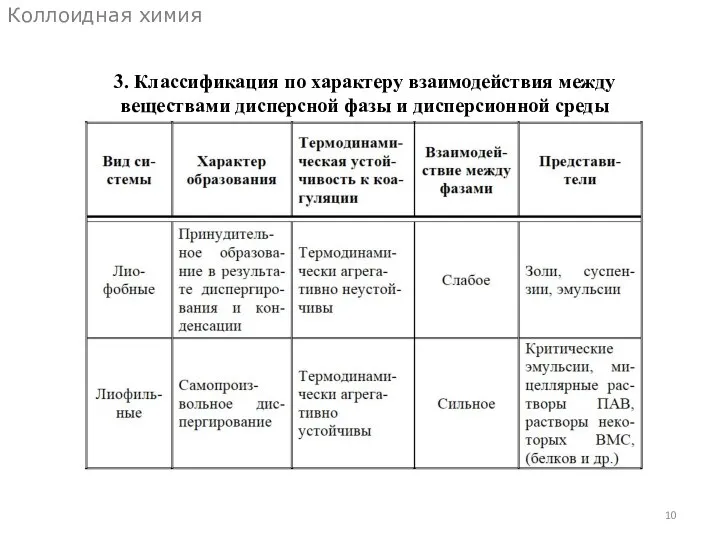
- 10. Коллоидная химия 3. Классификация по характеру взаимодействия между веществами дисперсной фазы и дисперсионной среды
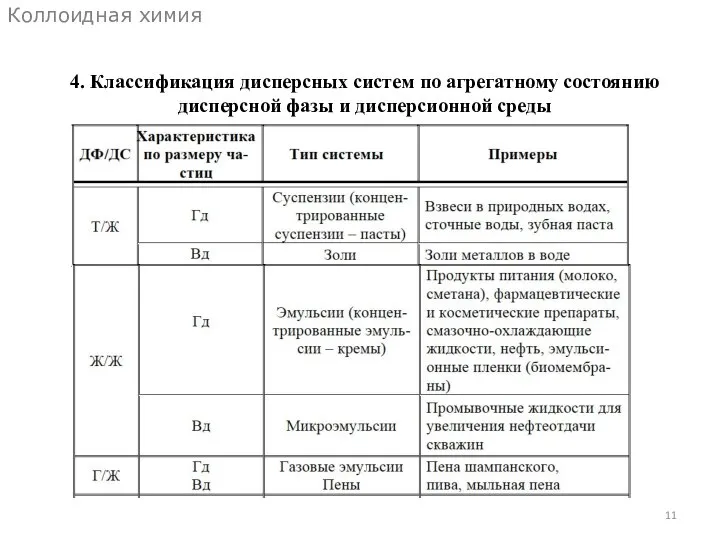
- 11. Коллоидная химия 4. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
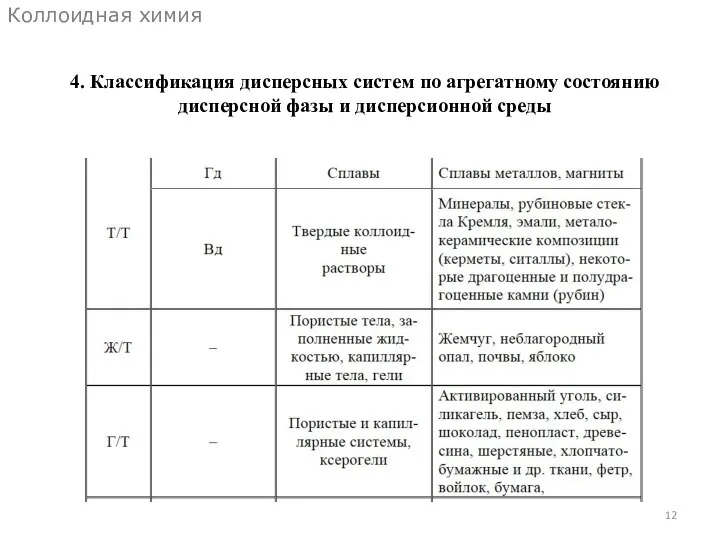
- 12. Коллоидная химия 4. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
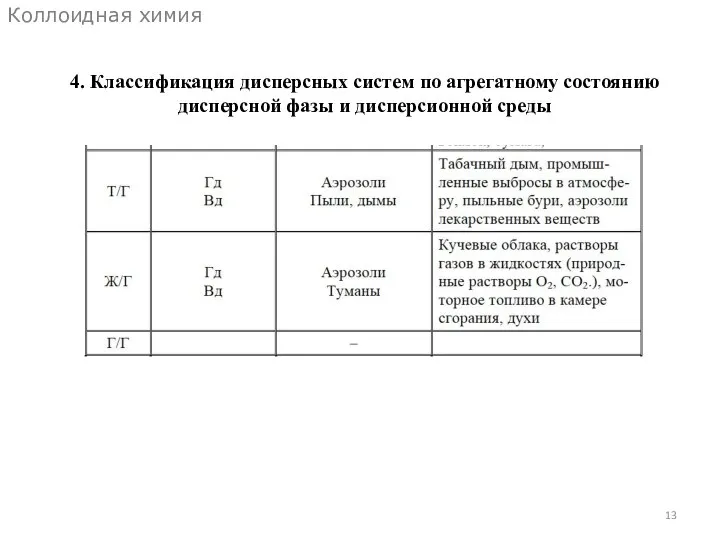
- 13. Коллоидная химия 4. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы и дисперсионной среды
- 14. Самопроизвольное диспергирование характерно для лиофильных систем. Несамопроизвольное диспергирование характерно для лиофобных систем. Несамопроизвольное диспергирование бывает: •
- 15. Пептизацией называют переход осадков под действием пептизаторов в состояние коллоидного раствора. Коллоидная химия
- 16. Пептизацией называют переход осадков под действием пептизаторов в состояние коллоидного раствора. Коллоидная химия
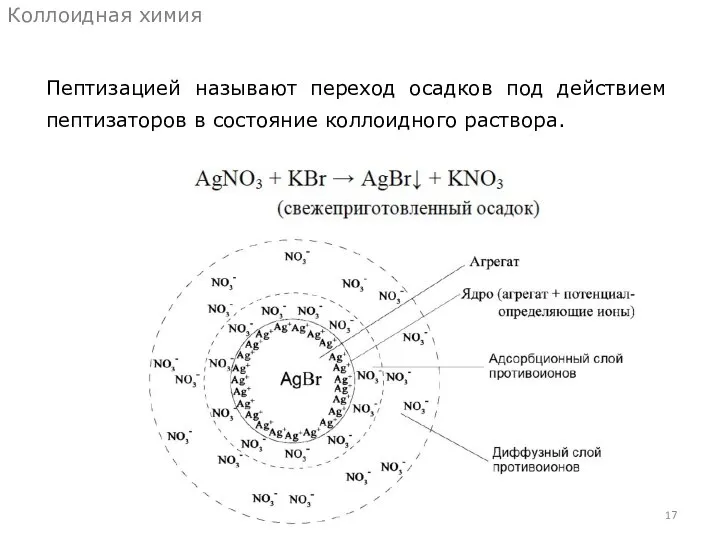
- 17. Пептизацией называют переход осадков под действием пептизаторов в состояние коллоидного раствора. Коллоидная химия
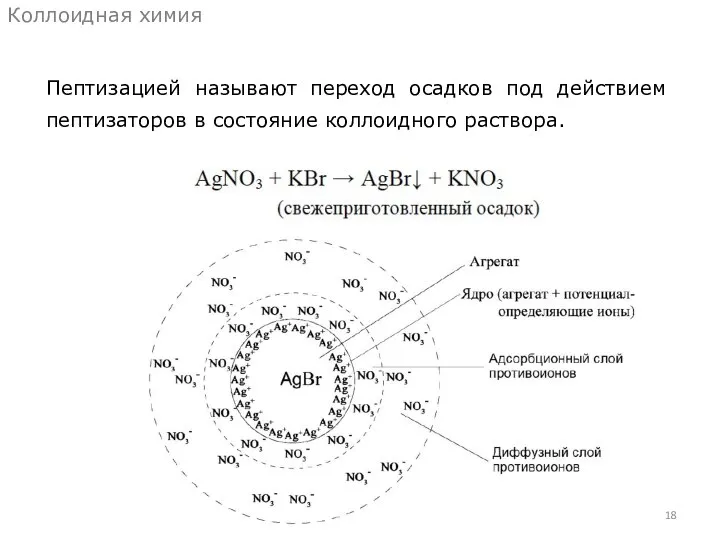
- 18. Пептизацией называют переход осадков под действием пептизаторов в состояние коллоидного раствора. Коллоидная химия
- 19. Дисперсионный анализ (ДА) – это совокупность методов измерения размеров частиц. Процедура ДА различается для высоко- и
- 20. Дисперсионный анализ (ДА) – это совокупность методов измерения размеров частиц. Процедура ДА различается для высоко- и
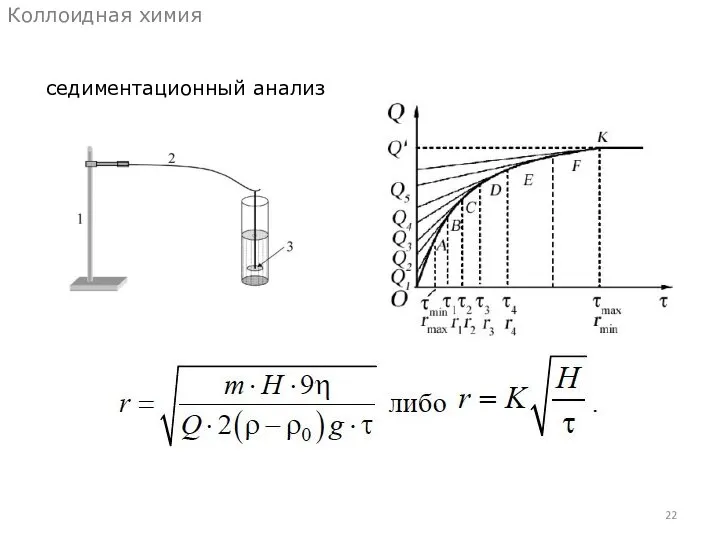
- 21. седиментационный анализ Коллоидная химия
- 22. седиментационный анализ Коллоидная химия
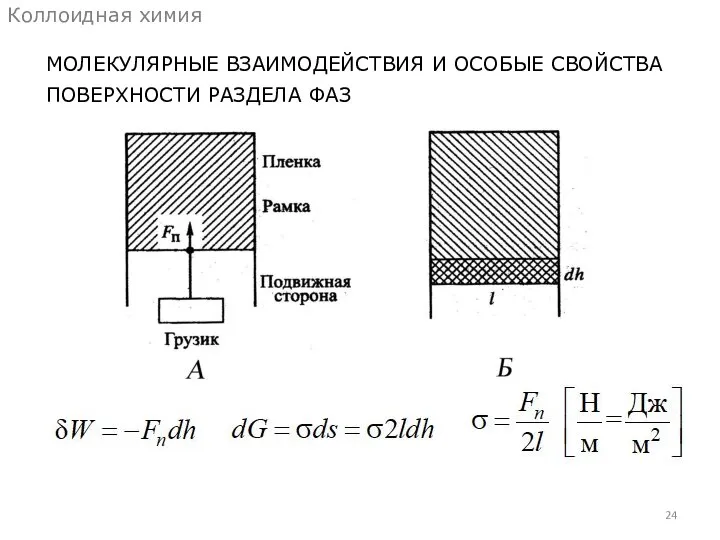
- 23. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Поверхностные молекулы втягиваются в глубь жидкости,
- 24. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия
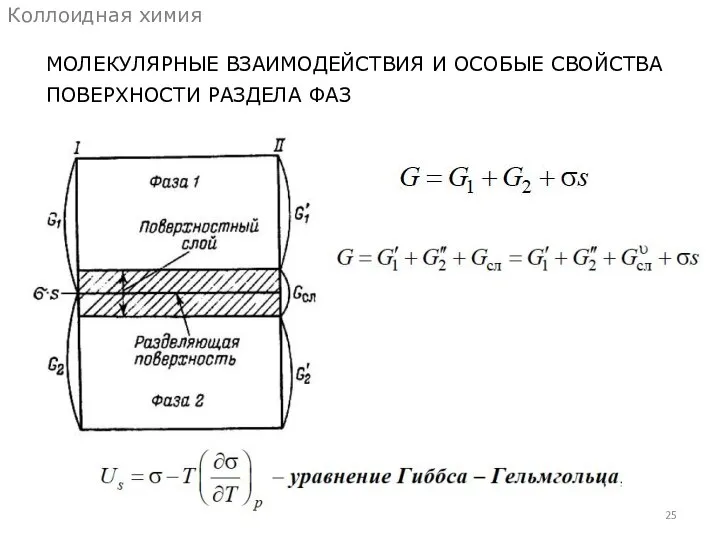
- 25. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия
- 26. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Адгезия – это слипание двух разнородных
- 27. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Работа когезии – работа, необходимая для
- 28. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Смачивание – разновидность адгезии, относящаяся к
- 29. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Адсорбция – самопроизвольное перераспределение компонентов между
- 30. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Полная адсорбция – количество вещества в
- 31. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Равновесие между объемными фазами и поверхностным
- 32. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Вещества, для которых Г > 0,
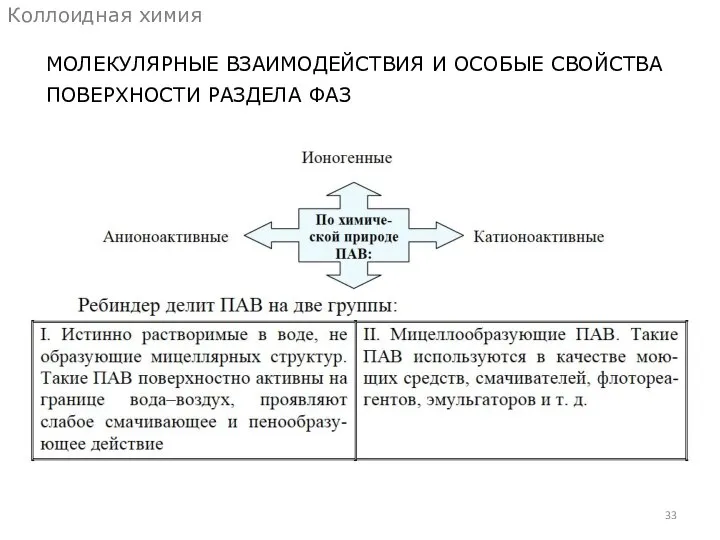
- 33. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия
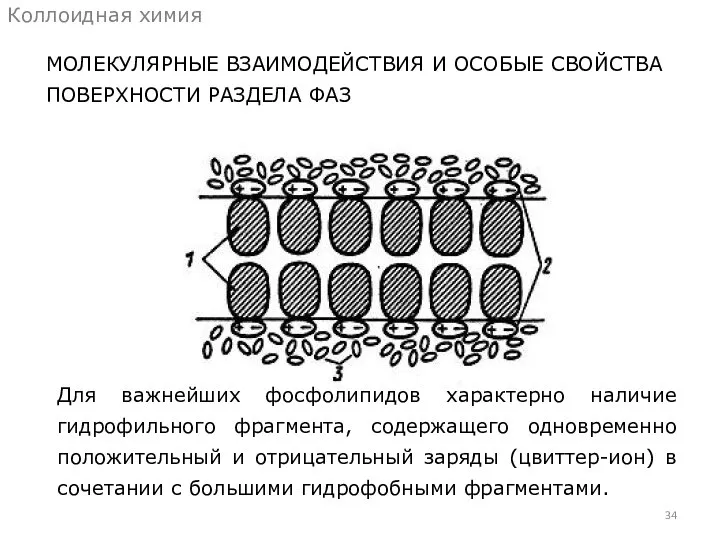
- 34. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Для важнейших фосфолипидов характерно наличие гидрофильного
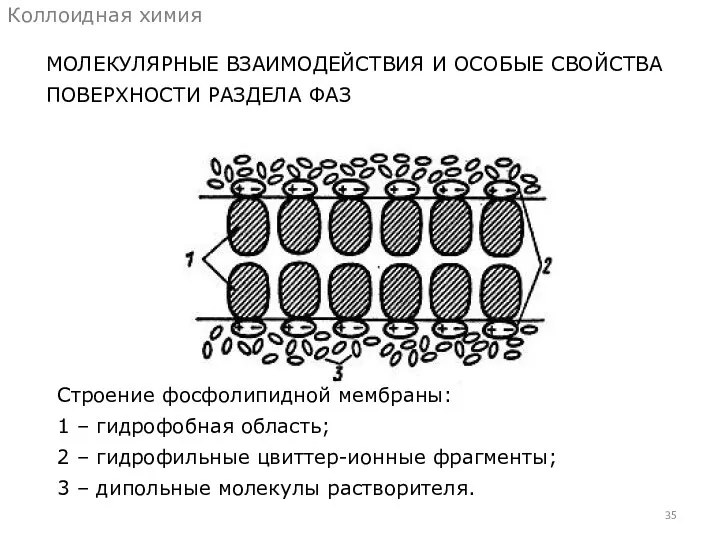
- 35. МОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ И ОСОБЫЕ СВОЙСТВА ПОВЕРХНОСТИ РАЗДЕЛА ФАЗ Коллоидная химия Строение фосфолипидной мембраны: 1 – гидрофобная
- 36. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ Коллоидная химия ДЭС – важнейший фактор, обеспечивающий агрегативную устойчивость дисперсных систем. В
- 37. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ Коллоидная химия Избирательная адсорбция регулируется правилом Фаянса –Панета: На поверхности твердого тела,
- 38. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ Коллоидная химия Заряд ядра мицеллы золя иодида серебра, получаемого по реакции AgNO3
- 39. ЭЛЕКТРИЧЕСКИЕ СВОЙСТВА ДИСПЕРСНЫХ СИСТЕМ Коллоидная химия Способность к адсорбции зависит от заряда и размера иона: чем
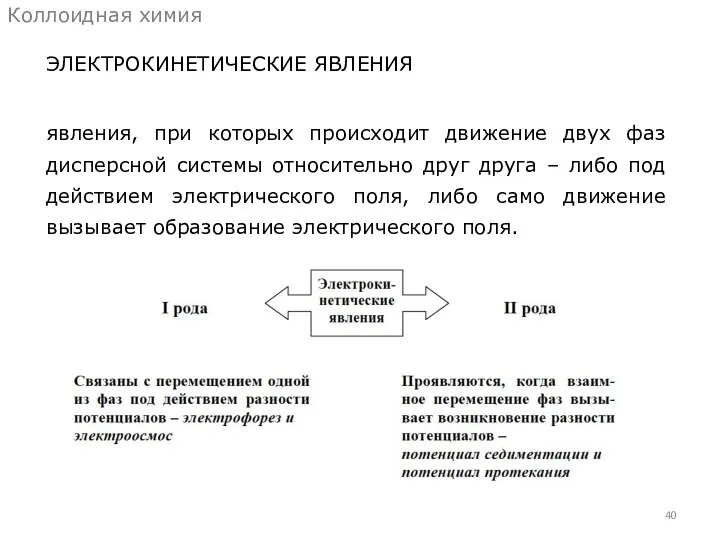
- 40. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ Коллоидная химия явления, при которых происходит движение двух фаз дисперсной системы относительно друг друга
- 41. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ Коллоидная химия Электрофорез (от греч. φορеο – увлекать) – это перемещение под действием электрического
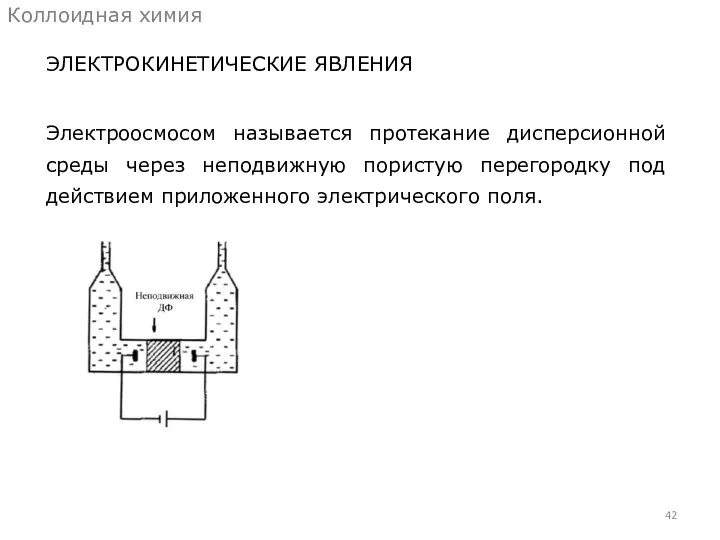
- 42. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ Коллоидная химия Электроосмосом называется протекание дисперсионной среды через неподвижную пористую перегородку под действием приложенного
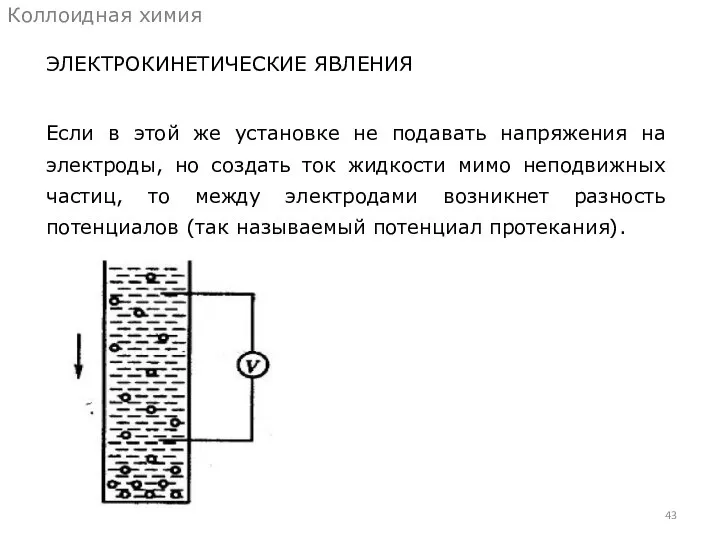
- 43. ЭЛЕКТРОКИНЕТИЧЕСКИЕ ЯВЛЕНИЯ Коллоидная химия Если в этой же установке не подавать напряжения на электроды, но создать
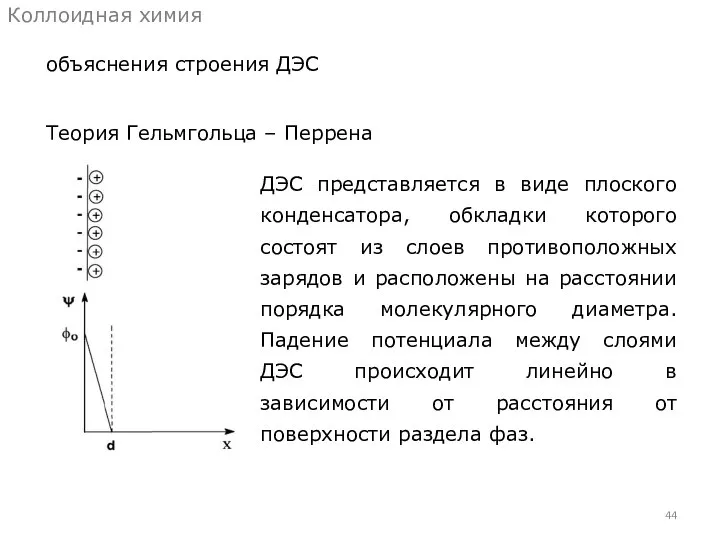
- 44. объяснения строения ДЭС Коллоидная химия Теория Гельмгольца – Перрена ДЭС представляется в виде плоского конденсатора, обкладки
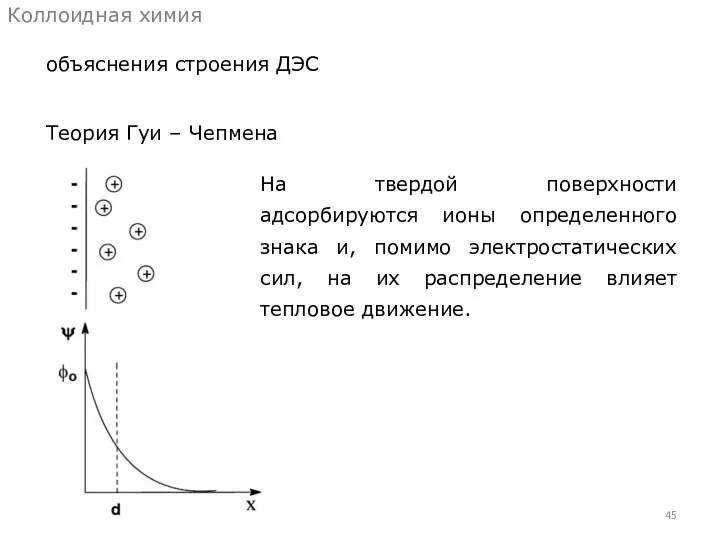
- 45. объяснения строения ДЭС Коллоидная химия Теория Гуи – Чепмена На твердой поверхности адсорбируются ионы определенного знака
- 47. Скачать презентацию























 Биологическое окисление
Биологическое окисление Основные диагностические признаки сапфира и его имитаций
Основные диагностические признаки сапфира и его имитаций Проект по химии. Минералы на нашей коже
Проект по химии. Минералы на нашей коже Химия и ее значение
Химия и ее значение Алкены (этиленовые углеводороды)
Алкены (этиленовые углеводороды) Основания
Основания Презентация на тему Углерод
Презентация на тему Углерод  Цинк и его применение (11 класс)
Цинк и его применение (11 класс) Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Водород, его общая характеристика, нахождение в природе и его свойства
Водород, его общая характеристика, нахождение в природе и его свойства Закономерности протеканий химических реакций
Закономерности протеканий химических реакций Вода
Вода Дистилляция (перегонка). 7 класс
Дистилляция (перегонка). 7 класс Инфракрасное электромагнитное излучение
Инфракрасное электромагнитное излучение Классы неорганических соединений
Классы неорганических соединений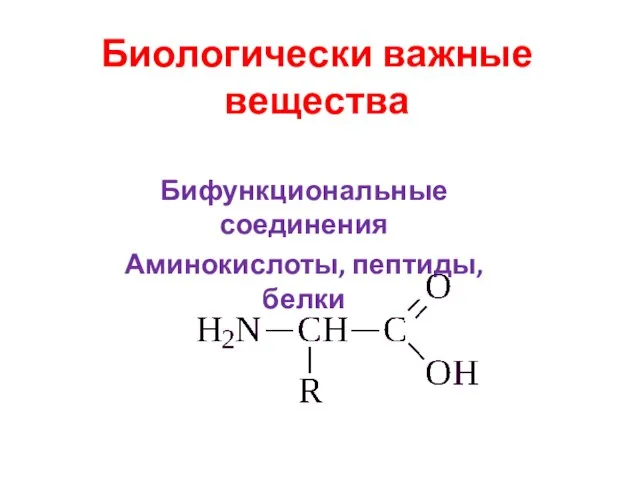 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Алюминий
Алюминий Расчеты по уравнениям химических реакций
Расчеты по уравнениям химических реакций Тест по теме Альдегиды и кетоны
Тест по теме Альдегиды и кетоны Презентация на тему Путешествие в мир химии
Презентация на тему Путешествие в мир химии  Проектная деятельность учащихся по химии
Проектная деятельность учащихся по химии Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6]
Определение количества этилендиамина в соединении [Gd(en)x][Fe(CN)6] Очистка рабочих электродов
Очистка рабочих электродов Изменение химмотологических свойств цетанповышающей присадки в процессе хранения
Изменение химмотологических свойств цетанповышающей присадки в процессе хранения Металлы тоже воевали… 8 класс
Металлы тоже воевали… 8 класс Получение и свойства полиэтилена
Получение и свойства полиэтилена Оценка качества пищевой соли, реализуемой в розничной торговле
Оценка качества пищевой соли, реализуемой в розничной торговле Термореактивные пластмассы (реактопласты)
Термореактивные пластмассы (реактопласты)