Содержание
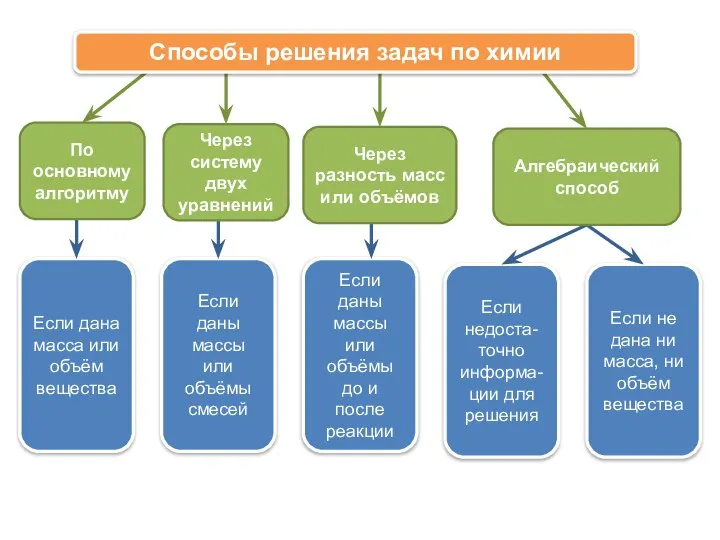
- 2. Если дана масса или объём вещества Если даны массы или объёмы смесей Если даны массы или
- 3. I. По основному алгоритму вогадро FeS + 2HCl → FeCl2 + H2S ↑ H2S + 2NaOH
- 4. I. По основному алгоритму
- 5. I. По основному алгоритму m (в-ва) = n·M m (в-ва) = m(р-ра)·ω(в-ва) m (в-ва) = V(р-ра)·ρ·ω(в-ва)
- 6. II. Через систему двух уравнений mсм = 33,3г mсм = 32,64г При обработке 33,3г смеси карбоната
- 7. II. Через систему двух уравнений Сколько литров СО и СО2 содержится в смеси, если известно, что
- 8. III. Через разность масс или объёмов 1) Δ V = 0,75л 2) Δ V = 3V
- 9. III. Через разность масс или объёмов Железная пластина массой 5г была погружена в 50 мл 15%
- 11. Скачать презентацию







 Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Сильные и слабые электролиты
Сильные и слабые электролиты Реакции соединения и разложения
Реакции соединения и разложения Углеводороды: получение и свойства
Углеводороды: получение и свойства Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции История развития органической химии. 10 класс
История развития органической химии. 10 класс Обсидиан
Обсидиан Соляная кислота и её соли
Соляная кислота и её соли Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом
Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Презентация по Химии "Биотрансформация чужеродных соединений в организме"
Презентация по Химии "Биотрансформация чужеродных соединений в организме"  Жидкое агрегатное состояние вещества. Растворы
Жидкое агрегатное состояние вещества. Растворы Цезий
Цезий Магний(Mg)
Магний(Mg) Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Предмет органической химии
Предмет органической химии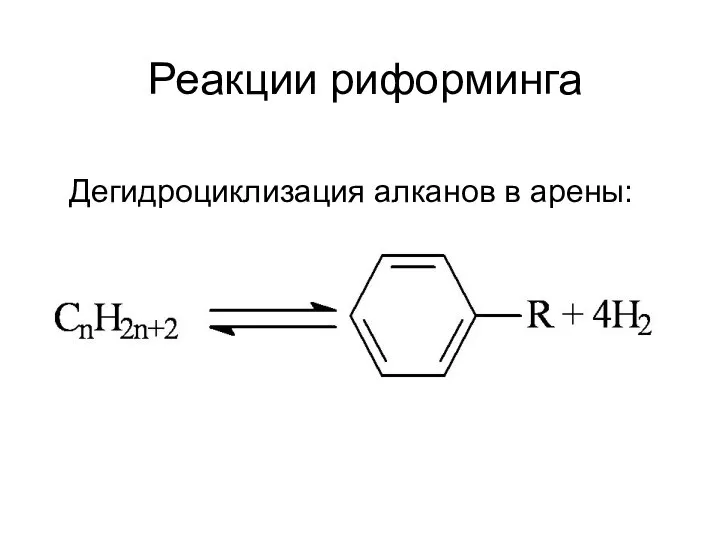 Реакции риформинга
Реакции риформинга Стереоизомерия
Стереоизомерия ОВР - метод полуреакции
ОВР - метод полуреакции Коштовне каміння
Коштовне каміння Вдоль по радуге
Вдоль по радуге Структура периодической таблицы
Структура периодической таблицы Соединения алифатического ряда
Соединения алифатического ряда Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Центрифугирование в гидробиологии
Центрифугирование в гидробиологии