Содержание
- 2. Рекомендуемая литература: Интернет ресурсы: www.jpegator.com, www.twirpx.com
- 3. ЛЕКЦИЯ №1 «СТРОЕНИЕ МЕТАЛЛОВ» Вопросы лекции: 1. Введение. 2. Атомно-кристаллическое строение металлов. 3. Строение реальных кристаллов.
- 4. 1. ВВЕДЕНИЕ Материаловедение - наука о материалах, связи их химического состава, строения и свойств. Предмет изучения
- 5. Теоретическая основа материаловедения – соответствующие разделы физики и химии, однако наука о материалах в основном развивается
- 6. 2. Атомно-кристаллическое строение металлов. Вещества могут находиться в 3 агрегатных состояниях – газообразном, жидком и твёрдом.
- 7. Аморфные тела, подобно жидкостям, обладают только ближним порядком расположения атомов и по существу являются переохлаждёнными жидкостями.
- 8. Свойства металлов обусловлены их атомным строением и типом связи между атомами. Различают четыре основных типа связи
- 9. Металлический тип связи осуществляется между атомами, когда число валентных электронов в атоме мало. В этом случае
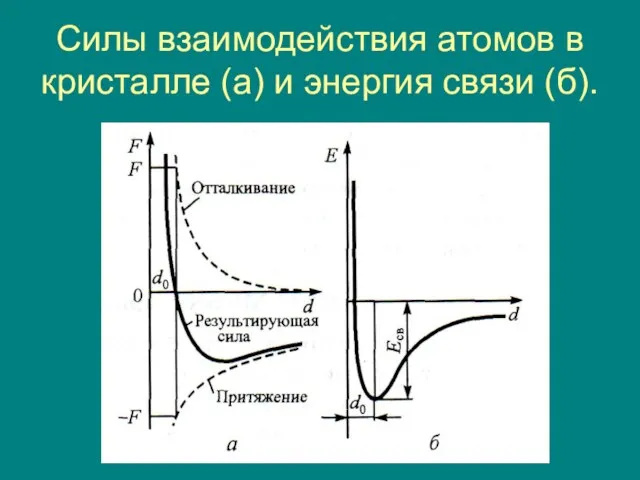
- 10. Силы взаимодействия атомов в кристалле (а) и энергия связи (б).
- 11. Частицы в кристалле сближаются на определенное расстояние, которое обеспечивает кристаллу наибольшую термодинамическую стабильность. Расстояние, на которое
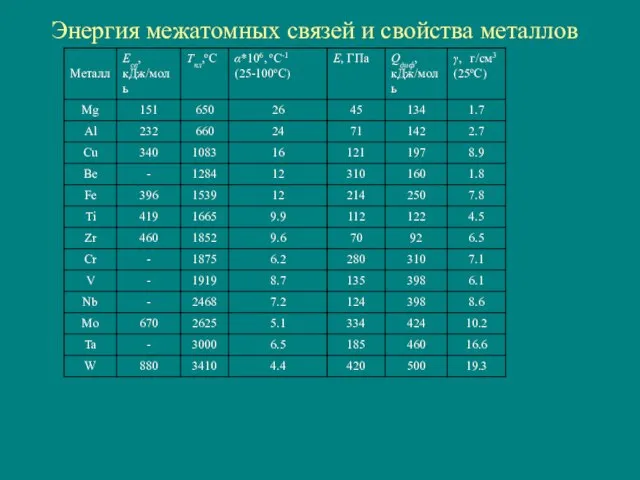
- 12. Энергия межатомных связей и свойства металлов
- 13. Классификация металлов Каждый металл отличается строением и свойствами от другого, тем не менее по некоторым признакам
- 14. Чёрные металлы Железные металлы – железо (Fe), кобальт (Со), никель (Ni) (так называемые ферромагнетики) и близкий
- 15. Цветные металлы Лёгкие металлы – бериллий (Ве), магний (Mg), алюминий (Al), обладающие малой плотностью. Благородные металлы
- 16. Металлы являются телами кристаллическими. В кристаллическом теле атомы (ионы) располагаются в строго определенном порядке и в
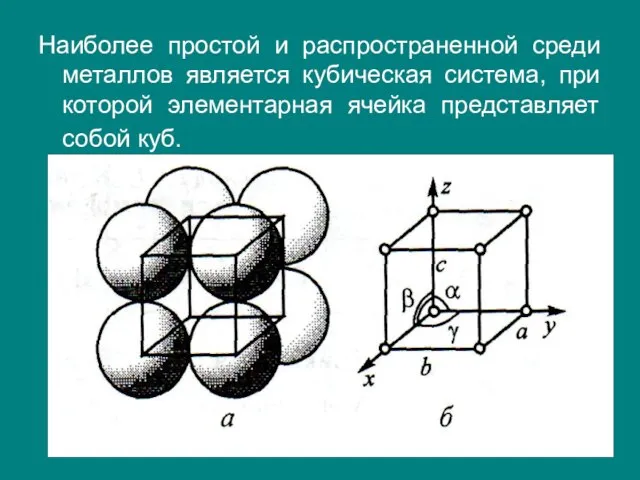
- 17. Наиболее простой и распространенной среди металлов является кубическая система, при которой элементарная ячейка представляет собой куб.
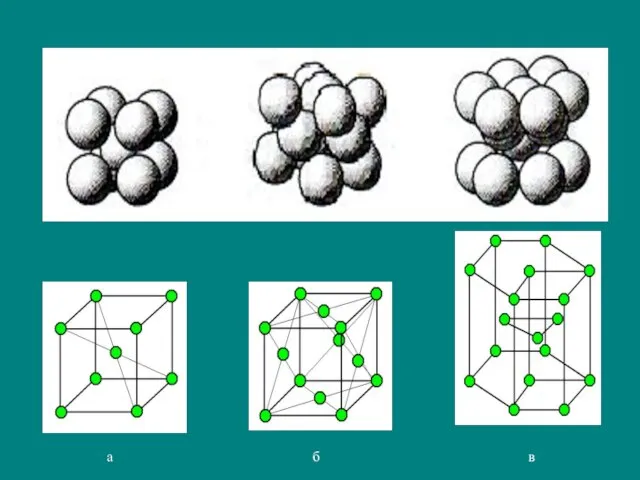
- 18. Для атомов одного размера имеется ограниченное число (14) возможных вариантов расположения атомов в пространстве. Гипотеза о
- 19. Элементарная ячейка - комплекс атомов, который при своем многократном повторении в пространстве позволяет воспроизводить пространственную кристаллическую
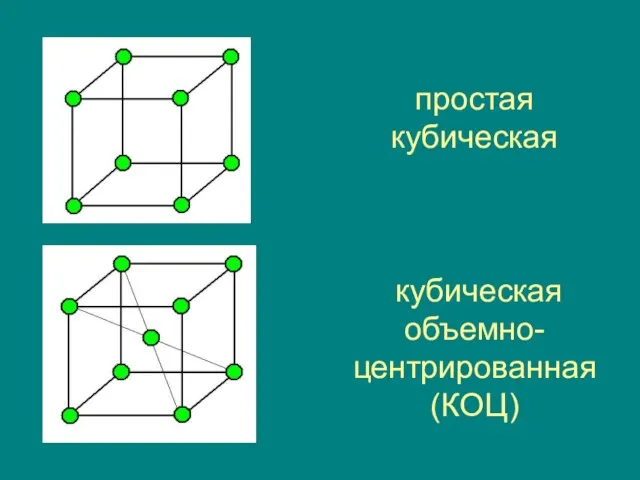
- 21. простая кубическая кубическая объемно-центрированная (КОЦ)
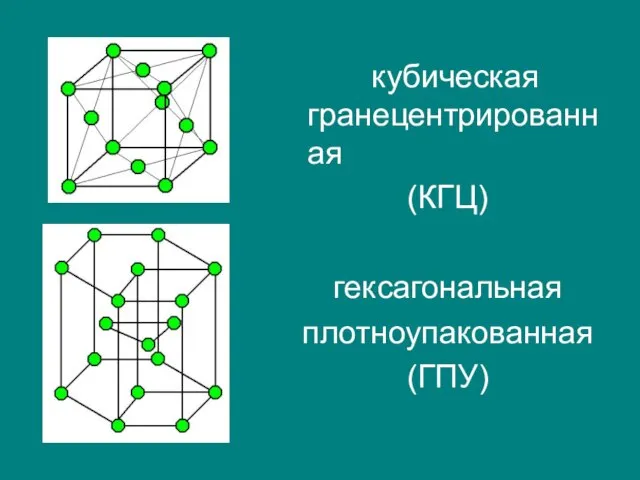
- 22. кубическая гранецентрированная (КГЦ) гексагональная плотноупакованная (ГПУ)
- 23. Основные параметры кристаллической решетки : период решетки – расстоянием между центрами соседних атомов, находящихся в узлах
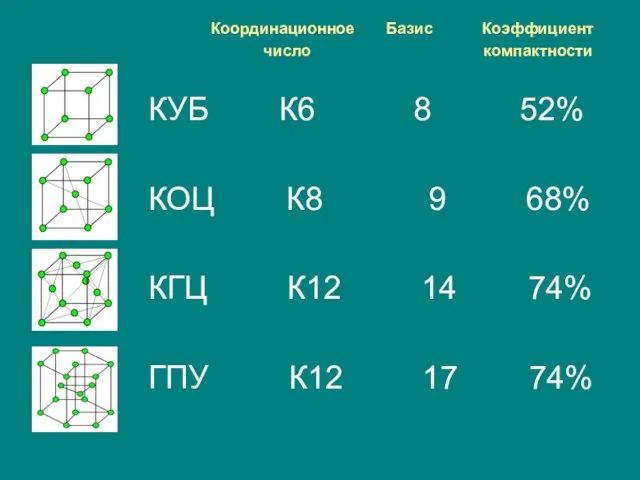
- 24. Координационное Базис Коэффициент число компактности КУБ К6 8 52% КОЦ К8 9 68% КГЦ К12 14
- 25. 3. Строение реальных кристаллов Реальные металлы и сплавы состоят не из одного монокристалла, а из большого
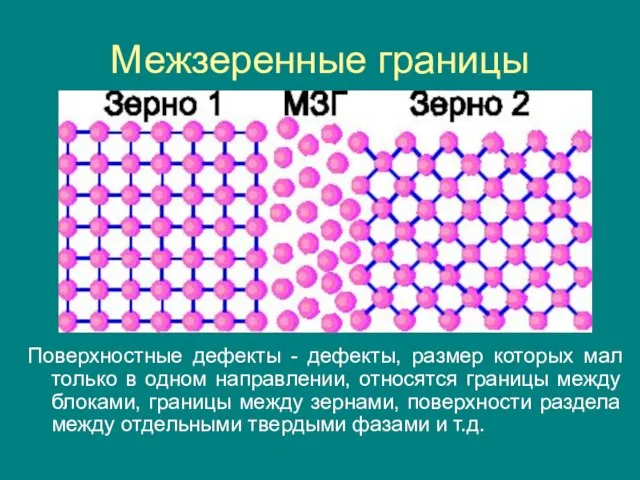
- 26. Межзеренные границы Поверхностные дефекты - дефекты, размер которых мал только в одном направлении, относятся границы между
- 27. Реальные кристаллы могут обладать и другими структурными несовершенствами или дефектами, т.е. отклонениями от правильного геометрического строения.
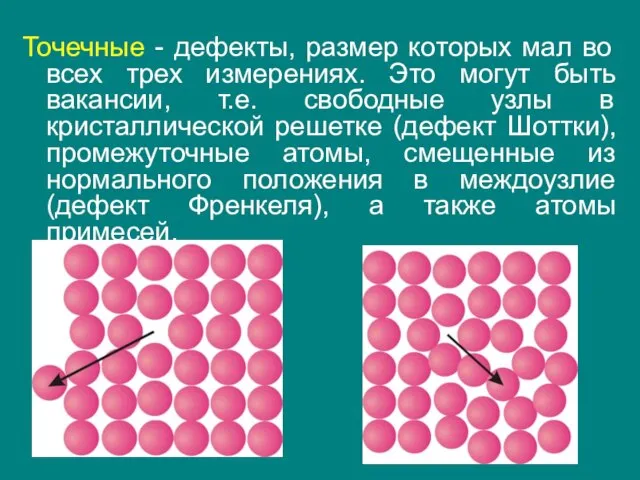
- 28. Точечные - дефекты, размер которых мал во всех трех измерениях. Это могут быть вакансии, т.е. свободные
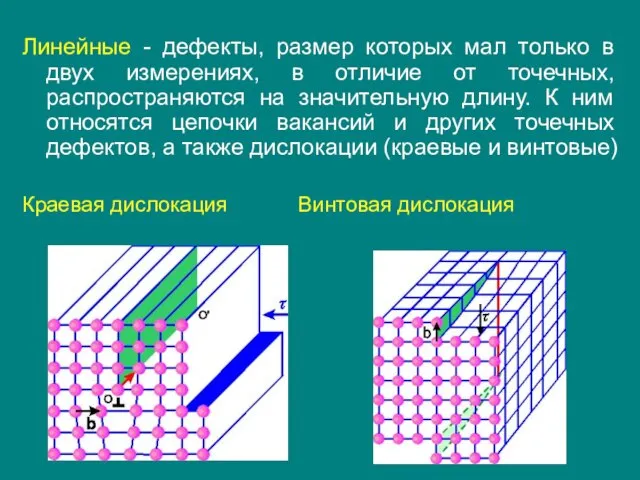
- 29. Линейные - дефекты, размер которых мал только в двух измерениях, в отличие от точечных, распространяются на
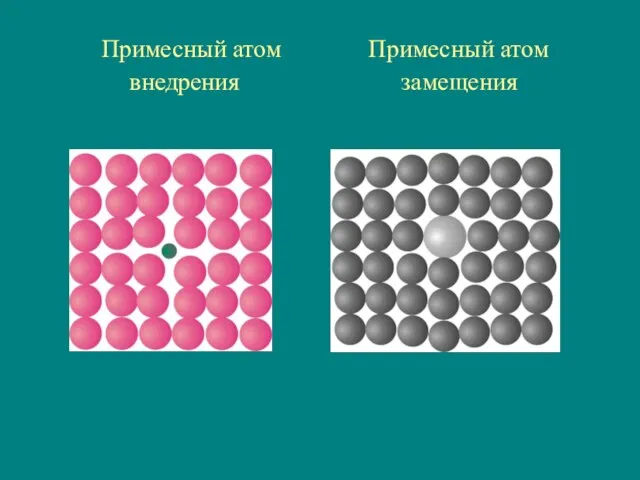
- 30. Примесный атом Примесный атом внедрения замещения
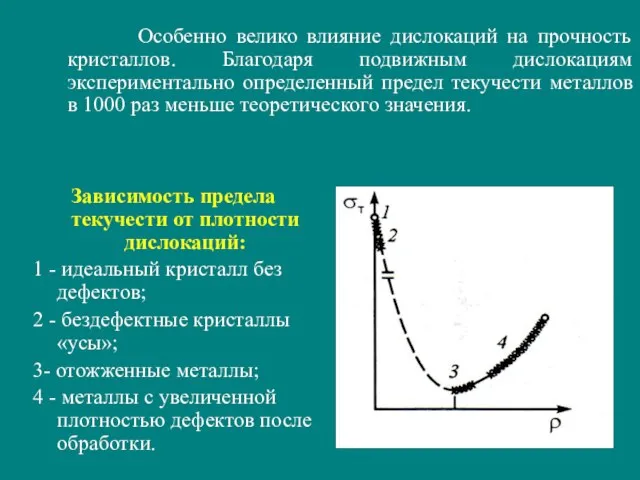
- 31. Дислокации появляются при кристаллизации и деформации кристалла, например, за счет сдвига или схлопывания вакансионных полостей. Дислокационные
- 32. Зависимость предела текучести от плотности дислокаций: 1 - идеальный кристалл без дефектов; 2 - бездефектные кристаллы
- 33. 4. Методы исследования структуры металлов Структура металла - форма, размеры и характер взаимного расположения соответствующих фаз
- 34. Макроанализ позволяет установить: строение металла (зернистое, дендритное), наличие и характер распределения зон кристаллизации, усадочной рыхлости, пузырей,
- 35. Микроструктура определяется микроанализом – исследование внутреннего строения металла с помощью оптического или электронного микроскопов. Микроструктура показывает
- 37. Скачать презентацию






















 Презентация на тему Массовая доля вещества в растворе
Презентация на тему Массовая доля вещества в растворе  Сильные и слабые электролиты
Сильные и слабые электролиты Реакции соединения и разложения
Реакции соединения и разложения Углеводороды: получение и свойства
Углеводороды: получение и свойства Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции
Оценка возможности повышения эффективности процесса гидрирования бутилен- бутадиеновой фракции История развития органической химии. 10 класс
История развития органической химии. 10 класс Обсидиан
Обсидиан Соляная кислота и её соли
Соляная кислота и её соли Общая характеристика МЕТАЛЛОВ
Общая характеристика МЕТАЛЛОВ Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом
Определение содержания иона цинка в фармацевтическом препарате гравиметрическим методом Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Презентация по Химии "Биотрансформация чужеродных соединений в организме"
Презентация по Химии "Биотрансформация чужеродных соединений в организме"  Жидкое агрегатное состояние вещества. Растворы
Жидкое агрегатное состояние вещества. Растворы Цезий
Цезий Магний(Mg)
Магний(Mg) Химическое равновесие в растворах электролитов
Химическое равновесие в растворах электролитов Предмет органической химии
Предмет органической химии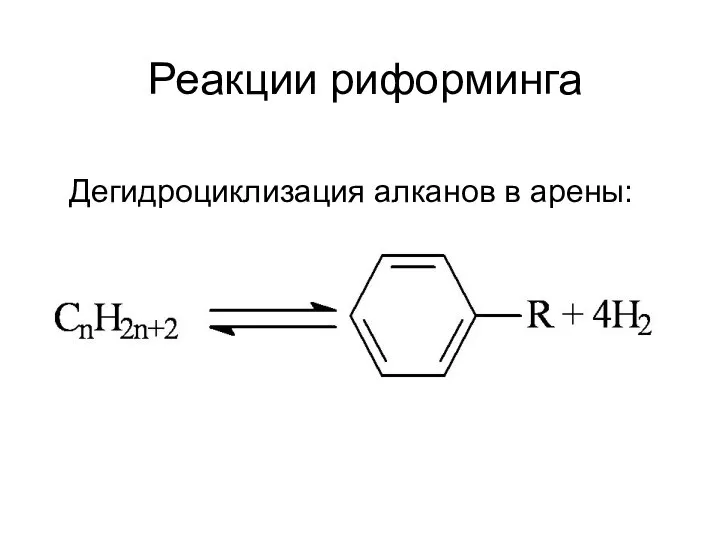 Реакции риформинга
Реакции риформинга Стереоизомерия
Стереоизомерия ОВР - метод полуреакции
ОВР - метод полуреакции Коштовне каміння
Коштовне каміння Вдоль по радуге
Вдоль по радуге Структура периодической таблицы
Структура периодической таблицы Соединения алифатического ряда
Соединения алифатического ряда Химические свойства металлов
Химические свойства металлов Коррозия металлов
Коррозия металлов Центрифугирование в гидробиологии
Центрифугирование в гидробиологии