Слайд 2« Просто знать - ещё не всё, знания нужно уметь использовать».
Гёте

Слайд 4Получение соляной кислоты:
1.В промышленности получают сжиганием водорода в хлоре и растворением продукта

реакции в воде.
2.В лаборатории
H2SO4 +2NaCl →2HCl ↑ + Na2SO4
Этот газ легко растворяется в воде: до 450 объемов хлороводорода - в одном объеме воды.
Слайд 5Химические свойства:
1. Изменение окраски индикатора (лакмус- красный)
2. Взаимодействует с металлами
Mg + 2HCl

→ MgCl2 + H2
2Al + 6HCl → 2AlCl3 + 3H2
Cu + HCl →
Слайд 6Вывод:
Если металл находится в ряду, составленном Н.Н.Бекетовым, до водорода, то выделяется водород

и образуется соль.
Исключение HNO3 (выделяются другие газы)
Слайд 73. Взаимодействует с основными и амфотерными оксидами:
MgO + 2HCl → MgCl2 +

H2O
ZnO + 2 HCl→ ZnCl2 + H2O
Образуются соль и вода
Слайд 84. Взаимодействует с основаниями:
HCl + KOH → KCl + H2O
3HCl + Al(OH)3

→ AlCl3 + 3H2O
Образуются соль и вода
Слайд 95. Взаимодействует с солями
Ряд кислот
HNO3
H2SO4, HCl, H2SO3, H2CO3, H2S,
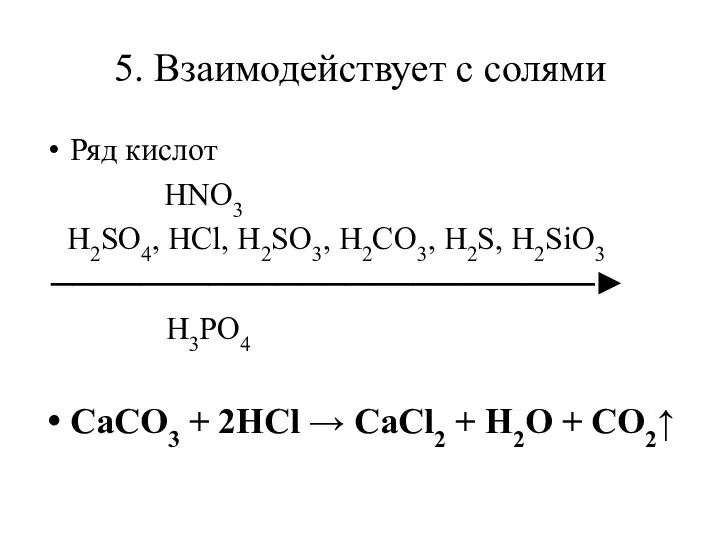
H2SiO3
────────────────────────►
H3PO4
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Слайд 10Вывод:
В соответствии с рядом кислот, каждая предыдущая кислота может вытеснить из соли

последующую, образуется другая кислота и другая соль.
Слайд 116. Взаимодействует с нитратом серебра
HCl + AgNO3 → AgCl↓ + HNO3
выпадает осадок

белого цвета, который не растворяется ни в воде, ни в кислотах.
Слайд 12Вывод:
Нитрат серебра является реактивом
на соляную кислоту и её соли т.е.
используется

в качестве качественной реакции, для распознавания хлорид-ионов.
Слайд 137. Взаимодействует с окислителями
Окислители: (MnO2, KMnO4, KClO3)
6HCl + KClO3 = KCl +
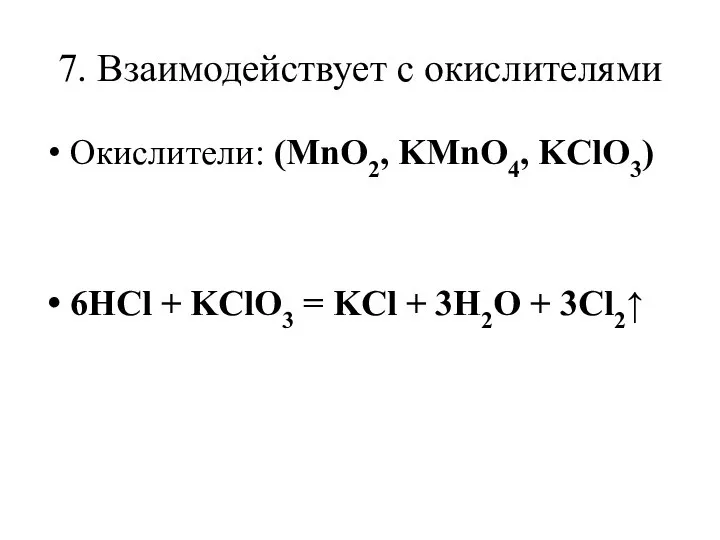
3H2O + 3Cl2↑
Слайд 14Вывод:
Во всех нами изученных реакциях получились
хлориды- соли соляной кислоты.

Слайд 15Применение соляной кислоты
Входит в состав желудочного сока и способствует перевариванию белковой пищи
Для

производства лекарств, красителей, растворителей, пластмасс.
Слайд 16
Применение солей - хлоридов
KCl - удобрение, используется также в стекольной и химической

промышленности.
HgCl2 - сулема - яд, для дезинфекции в медицине, для протравливания семян в сельском хозяйстве.
ZnCl2 - для пропитки древесины против гниения, в медицине, при паянии.
Слайд 17Задания для закрепления
№1. Осуществите превращения по схеме:
HCl → Cl2 → AlCl3 →Al(OH)3

→ Al2O3 →AlCl3 → Cl2
№2. Даны вещества:
Zn, Cu, Al, MgO, SiO2, Fe2O3, NaOH, Al(OH)3, Fe2(SO4)3, CaCO3, Fe(NO3)3
Какие из указанных веществ будут реагировать с соляной кислотой. Составьте уравнения химических реакций
Слайд 18№3. Решите задачу:
Какое количество алюминия прореагирует с избытком соляной кислоты для получения

5,6 л водорода (н.у.)?

















 Альдегиды. Общая формула
Альдегиды. Общая формула Презентация по Химии "Токсическое действие неорганических веществ"
Презентация по Химии "Токсическое действие неорганических веществ"  Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой
Разработка математического описания расчета октанового числа бензинов каталитического риформинга с групповой кинетикой Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами
Возможности окрашивания поверхности стекла путем высокотемпературной ионообменной обработки с выбранными реагентами Сфера влияния химии
Сфера влияния химии Углеводороды. Характеристика
Углеводороды. Характеристика 10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1)
10_KhimiaKlassifikatsia_organicheskikh_soedieniy (1) Таблица Менделеева
Таблица Менделеева Оксид цинка ZnO
Оксид цинка ZnO Ода стеклу и городу-герою Керчи
Ода стеклу и городу-герою Керчи Периодический закон. Периодическая таблица химических элементов. 8 класс
Периодический закон. Периодическая таблица химических элементов. 8 класс Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Амины. Номенклатура
Амины. Номенклатура Получение алканов
Получение алканов Гетероциклические соединения
Гетероциклические соединения Медь
Медь Коррозия металлов (9 класс)
Коррозия металлов (9 класс) Процессы и агрегаты нефтегазовых технологий
Процессы и агрегаты нефтегазовых технологий Липиды. Источники
Липиды. Источники Солевые кристаллы
Солевые кристаллы Сплавы на основе магния и титана
Сплавы на основе магния и титана Минералы. Самородные элементы
Минералы. Самородные элементы Ковалентная полярная химическая связь
Ковалентная полярная химическая связь Сравнительный анализ питьевой бутилированной воды
Сравнительный анализ питьевой бутилированной воды Азот
Азот Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Сравнение свойств неорганических и органических веществ
Сравнение свойств неорганических и органических веществ Презентация на тему Химическая связь (8 класс)
Презентация на тему Химическая связь (8 класс)