Содержание
- 2. Основные положения атомно-молекулярного учения Вещества состоят из молекул, а молекулы из атомов. Молекула –мельчайшая частица вещества,
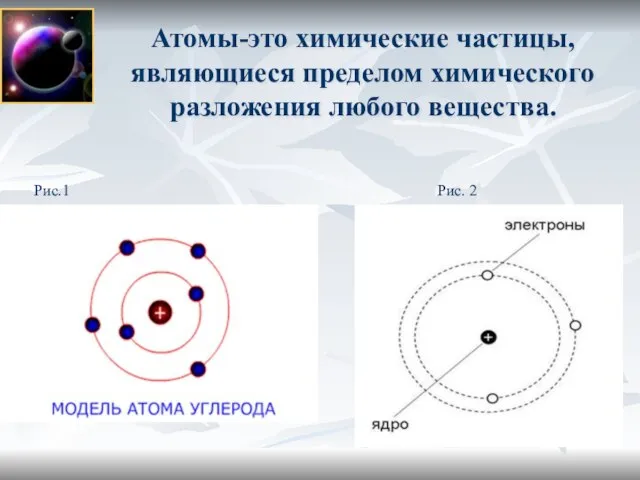
- 3. Атомы-это химические частицы, являющиеся пределом химического разложения любого вещества. Рис. 2 Рис.1
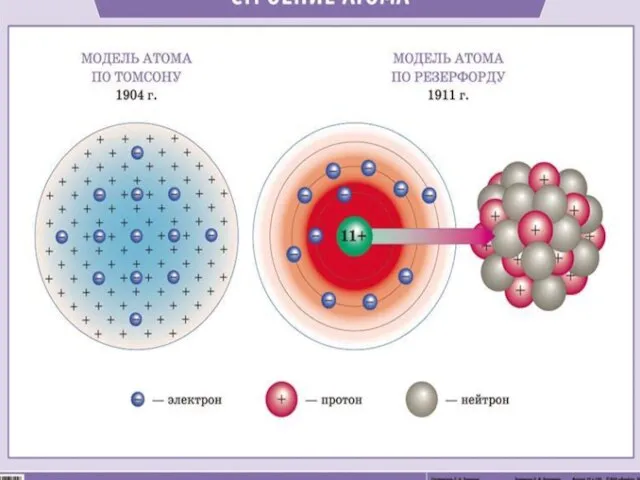
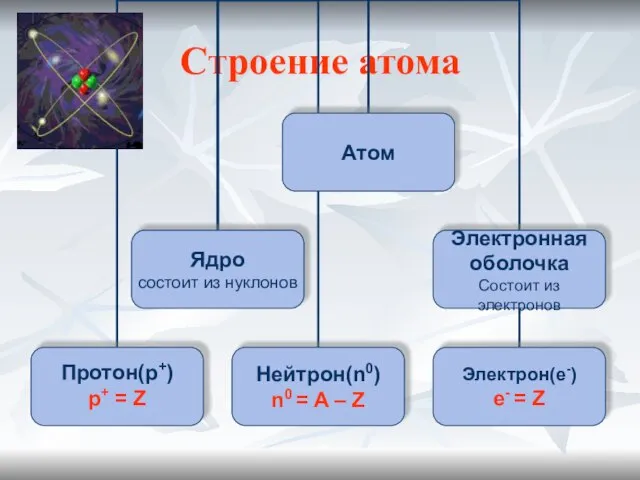
- 5. Строение атома
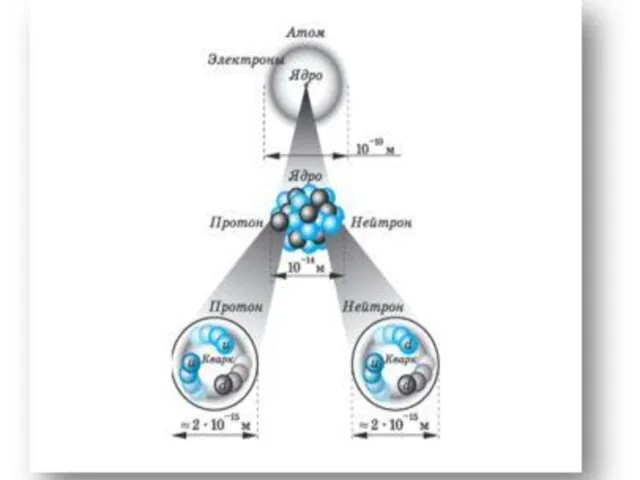
- 7. Планетарная модель атома Атом –это микрочастица, которая имеет форму шара. Атом –сложная система, состоящая из ядра
- 8. Изотопы состав изотопов хлора:35Сl и37Сl 1735Сl(17p++18n0) 17е- А=35 1737Сl(17p++20n0) 17е- А=37 Атомы изотопов одного элемента имеют
- 11. Для описания положения электронов в атоме используют 4 квантовых числа: Главное квантовое число n определяет уровень
- 12. Строение электронной оболочки атома Атомная орбиталь - состояние электрона в атоме. Каждой орбитали соответствует электронное облако.
- 13. Порядок заполнения электронами орбиталей атома определяется тремя законами природы: 1. Принцип наименьшей энергии - электроны заполняют
- 14. Распределение подуровней по энергиям выражается рядом (в прядке увеличения энергии): 1s, 2s, 2p, 3s, 3p, 4s,
- 15. 1.ВЕЩЕСТВО СОСТОИТ ИЗ ОГРОМНОГО КОЛИЧЕСТВА ЧАСТИЦ(АТОМОВ И МОЛЕКУЛ), МЕЖДУ КОТОРЫМИ ЕСТЬ ПРОМЕЖУТКИ; 2.МОЛЕКУЛА ВЕЩЕСТВА СОСТОИТ ИЗ
- 16. 1.ВЕЩЕСТВА СОСТОЯТ ИЗ АТОМОВ, ИОНОВ, МОЛЕКУЛ И КРИСТАЛЛОВ; 2.АТОМЫ ИМЕЮТ СЛОЖНОЕ СТРОЕНИЕ, ОПРЕДЕЛЕННЫЙ ВИД АТОМОВ НАЗЫВАЮТ
- 18. Скачать презентацию










 Презентация на тему Химические средства гигиены и косметика
Презентация на тему Химические средства гигиены и косметика  Презентация на тему Химический состав растений
Презентация на тему Химический состав растений  Оксиды, получение и свойства
Оксиды, получение и свойства Химическое равновесие
Химическое равновесие Ионы. Ионная связь.
Ионы. Ионная связь. Изготовление сложнопрофильных изделий из нитрида кремния
Изготовление сложнопрофильных изделий из нитрида кремния Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия
Омский государственный медицинский университет. Кафедра химии. Консультация. Дисциплина Биоорганическая химия Решение задач с учетом примесей в веществе
Решение задач с учетом примесей в веществе Железо в продуктах питания
Железо в продуктах питания صيغ المركبات وأسمائها
صيغ المركبات وأسمائها Физические свойства металлов
Физические свойства металлов Алкены-2 (электрофильные реакции)
Алкены-2 (электрофильные реакции) Дисперсные системы
Дисперсные системы Основания, их классификация и свойства
Основания, их классификация и свойства Получение и применение алкенов
Получение и применение алкенов Азот. Физические свойства азота
Азот. Физические свойства азота Морфологія та походження мінералів. Елементи кристалографії
Морфологія та походження мінералів. Елементи кристалографії Изомерия аминокислот
Изомерия аминокислот Физический этап развития периодического закона
Физический этап развития периодического закона Презентация на тему Химические свойства металлов
Презентация на тему Химические свойства металлов  Скорость химических реакций
Скорость химических реакций Мыло. Синтетические моющие средства
Мыло. Синтетические моющие средства Кислоты и соли
Кислоты и соли Ароматические углеводороды. Бензол
Ароматические углеводороды. Бензол Химические свойства солей
Химические свойства солей Фосфор, строение, свойства
Фосфор, строение, свойства Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич
Неорганическая химия 8 класс Старо – Арышская ср.школа учитель: Гатиятуллин Ильназ Вакилевич Анализ саморазряда элементов литий-дисульфид железа
Анализ саморазряда элементов литий-дисульфид железа