Содержание
- 2. Цели урока Сформировать понятие о составе атома и атомного ядра Научиться определять состав атома Показать взаимодействие
- 3. Задание: Запишите 3 молекулы серной кислоты, если известно, что в состав молекулы входят 2 атома водорода,
- 4. Задание: В предложения вставьте слова «атом» или «молекула»: … образована … водорода. … углекислого газа образована
- 5. СЛОВО «АТОМ» ПРИДУМАЛ БОЛЕЕ 2500 ЛЕТ НАЗАД ДРЕВНЕГРЕЧЕСКИЙ ФИЛОСОФ ДЕМОКРИТ АТОМ – ЭТО МЕЛЬЧАЙШАЯ ХИМИЧЕСКИ НЕДЕЛИМАЯ
- 6. МОДЕЛЬ АТОМА ТОМСОНА Атом, по мысли Дж. Томсона, очень похож на пудинг с изюмом: электроны, как
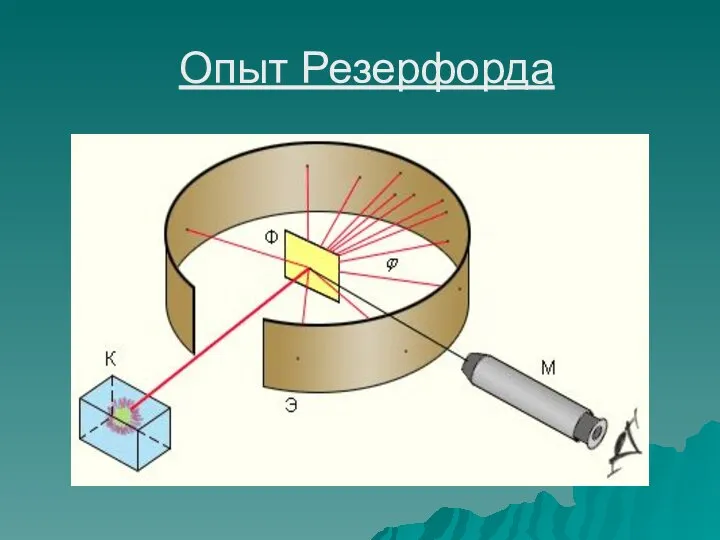
- 7. Эрнест Резерфорд Цель эксперимента Э.Резерфорда: проверить гипотезу Дж. Томсона на опыте. С точки зрения Резерфорда α-
- 8. Опыт Резерфорда
- 9. Модель атома Резерфорда В центре атома находится положительно заряженное ядро В центре атома находится положительно заряженное
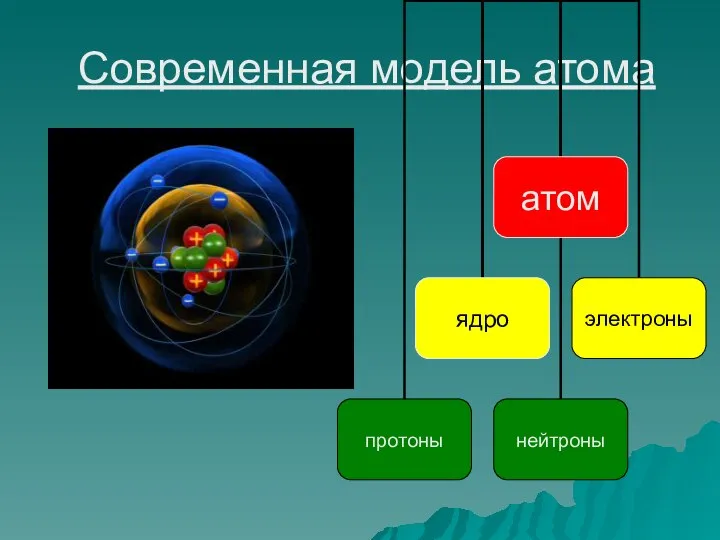
- 10. Состав ядра атома Ядро-это центральная часть атома, в котором сосредоточена практически вся его масса. Оно состоит
- 11. Таблица элементарных частиц
- 12. Современная модель атома
- 13. Z – порядковый номер химического элемента A – массовое число, A=Ar N – число нейтронов
- 14. Число p Z p = Z (порядковому номеру химического элемента) Число ē Z ē = Z
- 15. Сумму чисел протонов и нейтронов в атоме называют массовым числом. Например, массовое число атома алюминия: 13+14=27,
- 16. Вопросы: Определите число протонов, электронов и нейтронов в атомах элементов: натрия, фосфора, золота. Порядковый номер элемента
- 17. Атом нейтрален, так как число протонов равно числу электронов
- 18. УСЛОВНОЕ ОБОЗНАЧЕНИЕ ЯДРА ХИМИЧЕСКОГО ЭЛЕМЕНТА Х - СИМВОЛ ХИМИЧЕСКОГО ЭЛЕМЕНТА Z - ЗАРЯД ЯДРА А –
- 19. В периодической таблице приведены не целые, а дробные значения относительных атомных масс. Чем это можно объяснить?
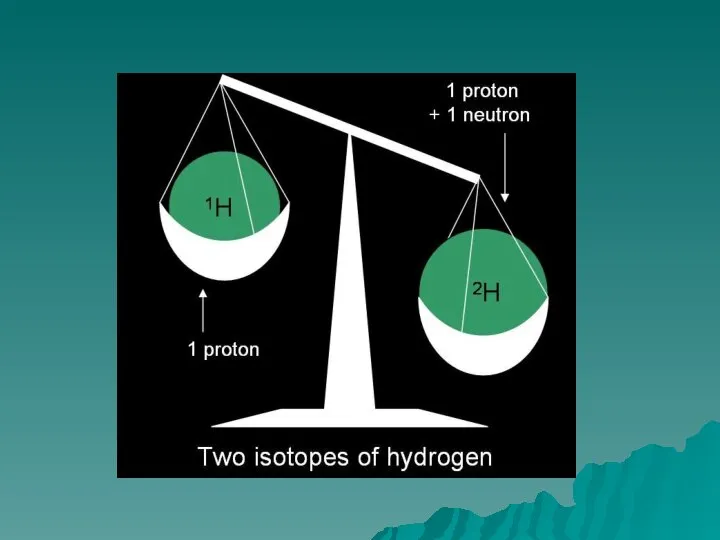
- 21. ИЗОТОПЫ – это разновидности атомов одного химического элемента, которые отличаются числом нейтронов в ядре, то есть
- 22. ХИМИЧЕСКИЕ ЭЛЕМЕНТЫ, КОТОРЫЕ СОСТОЯТ ТОЛЬКО ИЗ РАДИОАКТИВНЫХ ИЗОТОПОВ, НАЗЫВАЮТСЯ РАДИОАКТИВНЫМИ (порядковые номера более 83)
- 23. Почему относительная атомная масса выражается не целым числом? ОТНОСИТЕЛЬНАЯ АТОМНАЯ МАССА ХИМИЧЕСКОГО ЭЛЕМЕНТА РАССЧИТЫВАЕТСЯ С УЧЕТОМ
- 24. Например, Хлор в природе встречается в виде изотопов 35Cl (75%) и 37Cl (25%) Вычислите относительную атомную
- 25. ХИМИЧЕСКИЙ ЭЛЕМЕНТ – это вид атомов с одинаковым зарядом ядра. Химические свойства изотопов одного и того
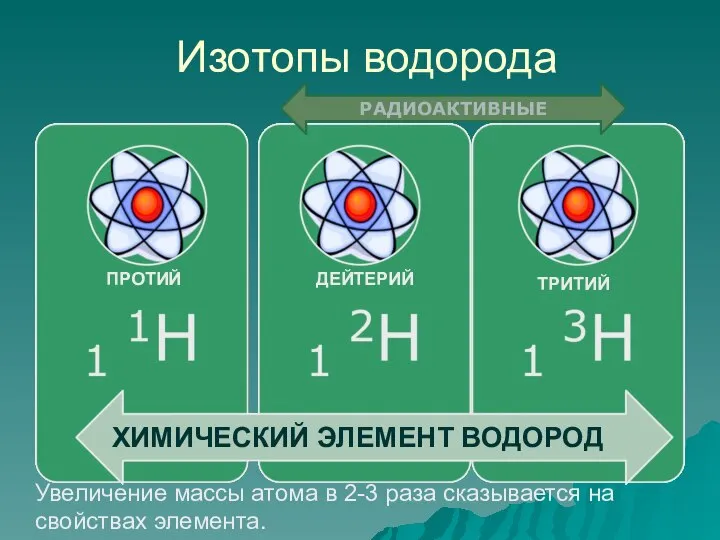
- 26. Изотопы водорода ХИМИЧЕСКИЙ ЭЛЕМЕНТ ВОДОРОД ПРОТИЙ ДЕЙТЕРИЙ ТРИТИЙ РАДИОАКТИВНЫЕ Увеличение массы атома в 2-3 раза сказывается
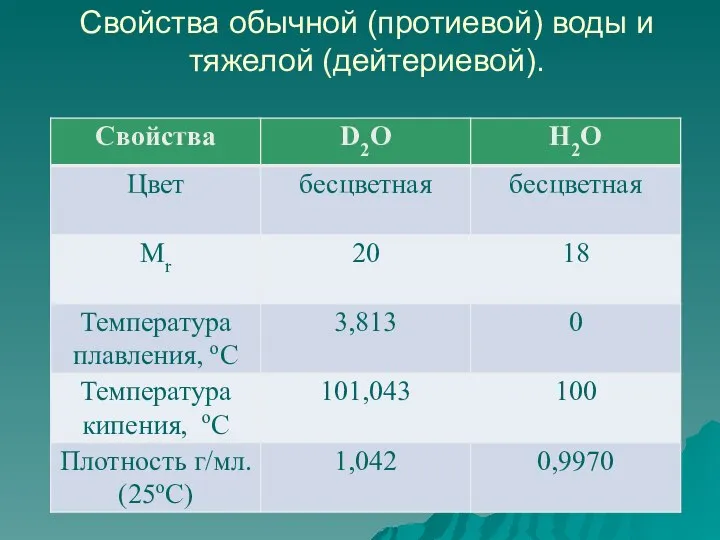
- 27. Свойства обычной (протиевой) воды и тяжелой (дейтериевой).
- 28. Объясните, почему в периодической таблице в некоторых случаях элементы с большей относительной атомной массой стоят впереди
- 29. Это зависит от того, каких изотопов (легких или тяжелых) у данного элемента встречается больше в природе.
- 30. Тест на тему «Строение атома» 1. Положительно заряженная частица называется А)электрон Б)протон В)нейтрон 2. Отрицательно заряженная
- 31. 5. Вокруг ядра вращаются… А)электроны Б)нейтроны В) протоны 6. В переводе с греческого «атом» означает: А)
- 33. Скачать презентацию

























 Химический тренажер
Химический тренажер Лакмусовые бумажки из сока краснокочанной капусты
Лакмусовые бумажки из сока краснокочанной капусты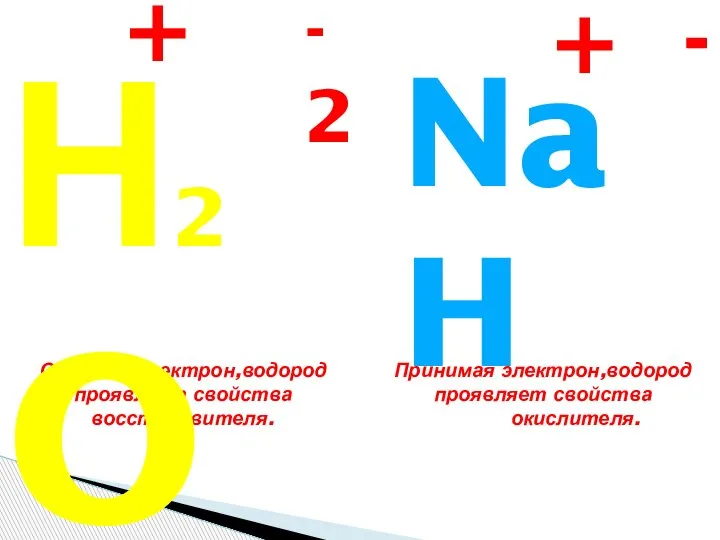 Кислород и водород
Кислород и водород Эмульсии как лиофобные дисперсные системы
Эмульсии как лиофобные дисперсные системы Направление процесса. ОВР
Направление процесса. ОВР Spectroscopy. U.V. Lect.2
Spectroscopy. U.V. Lect.2 Металлы. Д.И. Менделеев
Металлы. Д.И. Менделеев Значение воды на Земле
Значение воды на Земле Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации
Анализ лекарственных форм с витаминами и использование физико-химических и химических методов анализа. Вопросы стабилизации Наноматериалы и нанотехнологии
Наноматериалы и нанотехнологии Галогены
Галогены Презентация на тему Соединения азота
Презентация на тему Соединения азота  Кислоты
Кислоты Виды лабораторной посуды и её применение в исследовательской работе
Виды лабораторной посуды и её применение в исследовательской работе Научный эксперимент в химической технологии
Научный эксперимент в химической технологии Водные растворы электролитов
Водные растворы электролитов Оксиды. Классификация оксидов
Оксиды. Классификация оксидов Уран гексафториді
Уран гексафториді Виды химической связи
Виды химической связи Техника безопасности (3)
Техника безопасности (3) Физический этап развития периодического закона
Физический этап развития периодического закона Презентация на тему Решение задач на смеси, сплавы, растворы
Презентация на тему Решение задач на смеси, сплавы, растворы  Инертные газы
Инертные газы Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс
Основные классы неорганических соединений. Общие формулы оксидов, оснований, кислот, солей. 8 класс Техника титрования и лабораторная посуда
Техника титрования и лабораторная посуда Ароматические углеводороды - Арены
Ароматические углеводороды - Арены Спирты. Тест
Спирты. Тест Презентация на тему Электролитическая диссоциация
Презентация на тему Электролитическая диссоциация