Содержание
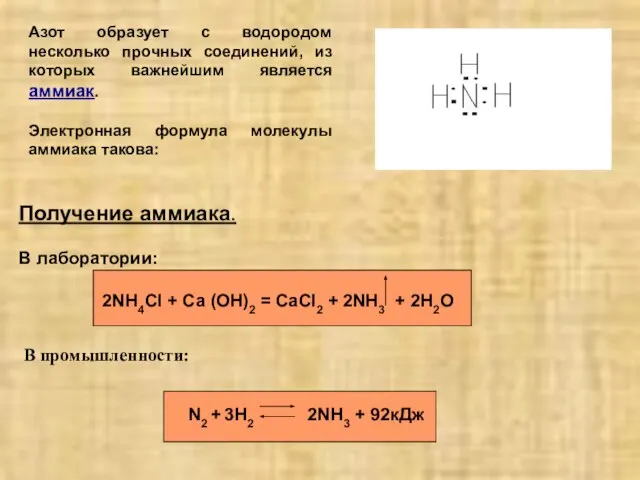
- 2. Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака
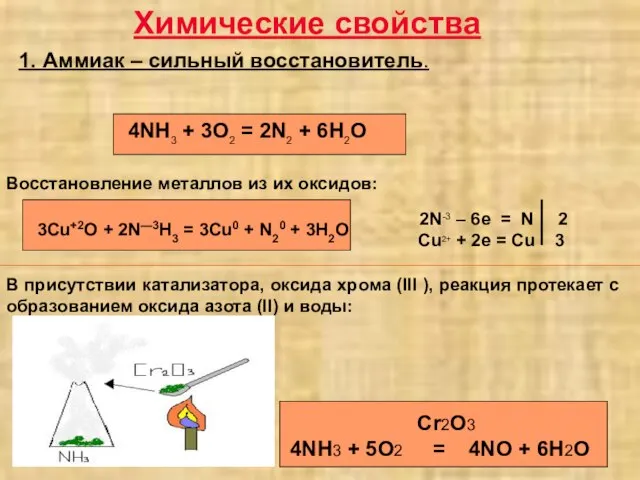
- 3. Химические свойства 1. Аммиак – сильный восстановитель. 3Cu+2O + 2N—3H3 = 3Cu0 + N20 + 3H2O
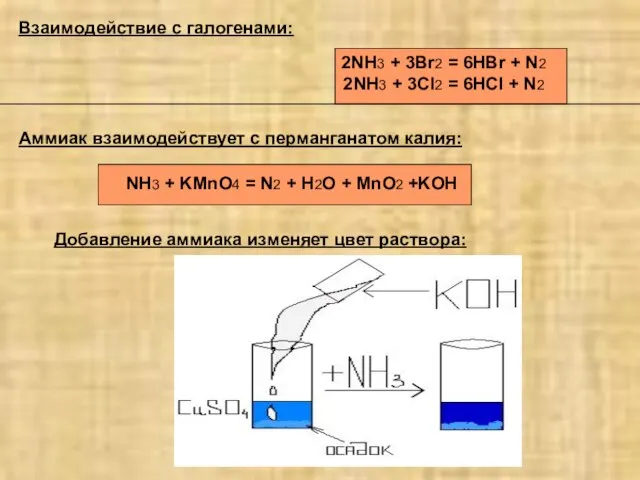
- 4. Аммиак взаимодействует с перманганатом калия: NH3 + KMnO4 = N2 + H2O + MnO2 +KOH Взаимодействие
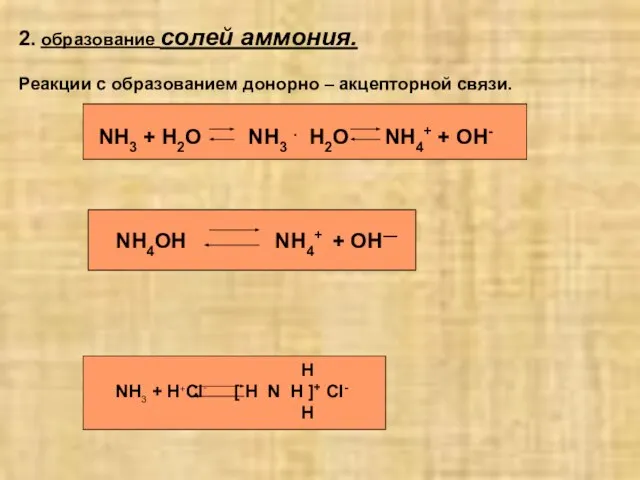
- 5. 2. образование солей аммония. Реакции с образованием донорно – акцепторной связи. NH3 + H2O NH3 .
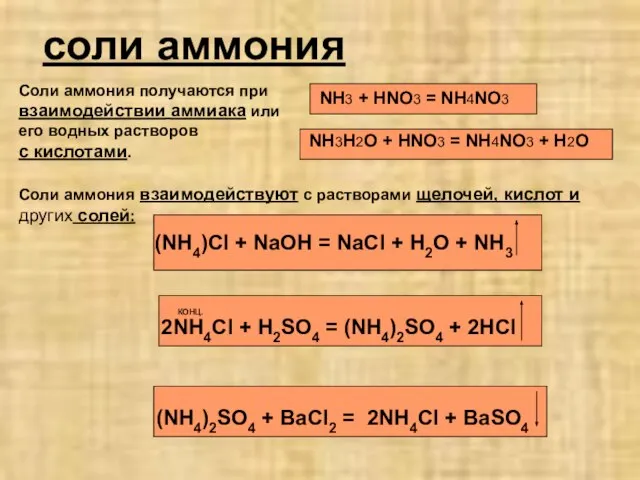
- 6. соли аммония Соли аммония получаются при взаимодействии аммиака или его водных растворов с кислотами. NH3 +
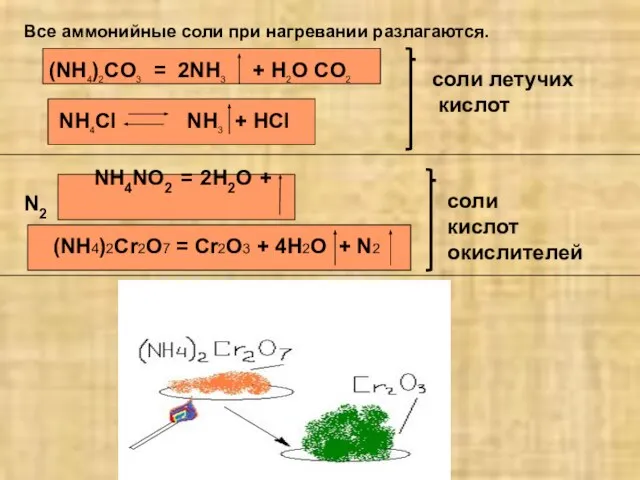
- 7. Все аммонийные соли при нагревании разлагаются. (NH4)2CO3 = 2NH3 + H2O CO2 NH4NO2 = 2H2O +
- 8. Качественная реакция на ион аммония. NH4+ + OH- H2O + NH3 Очень важным свойством солей аммония
- 9. Оксиды азота. Азот образует шесть кислородных соединений. степени окисления +1 N2O +2 NO +3 N2O3 +4
- 10. N2O Получение: NH4NO = N2O +2H2O Химические свойства: 1. разложение при нагревании 2N2+1O = 2N20+O2 2.
- 11. NO +2 Получение: 1. В природе: N2 + O2 = 2NO 2. В промышленности: 4NH3 +
- 12. N2O3 +3 Химические свойства: NO2 + NO N2O3 Получение: ВСЕ свойства кислотных оксидов. кислотный оксид
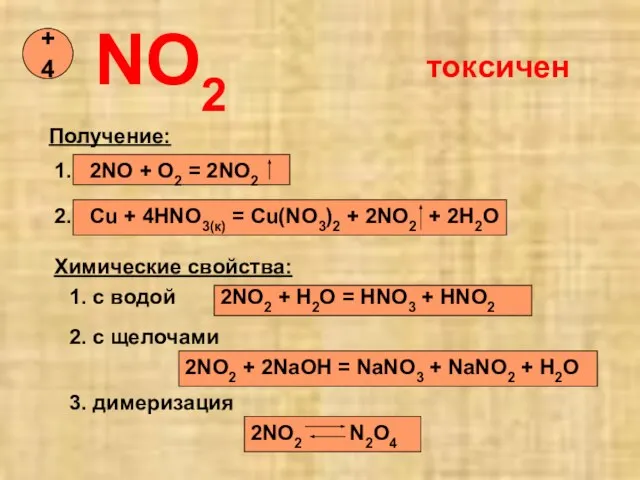
- 13. NO2 +4 Получение: 1. 2NO + O2 = 2NO2 2. Cu + 4HNO3(к) = Cu(NO3)2 +
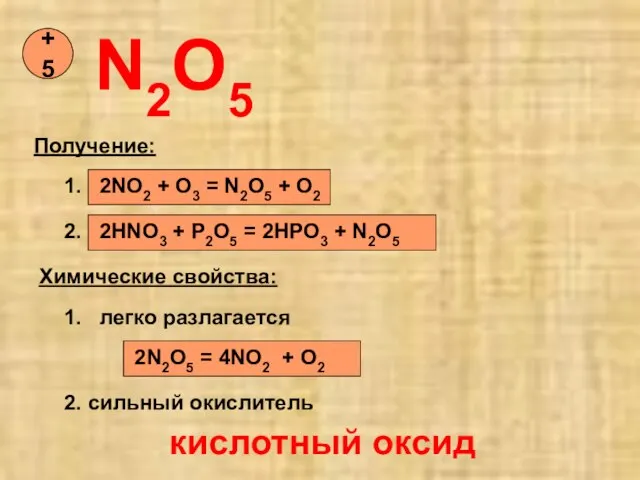
- 14. N2O5 +5 Получение: 1. 2NO2 + O3 = N2O5 + O2 2. 2HNO3 + P2O5 =
- 15. Азотная кислота. Получение азотной кислоты: KNO3 + H2SO4 = HNO3 + KHSO4 В лаборатории, при слабом
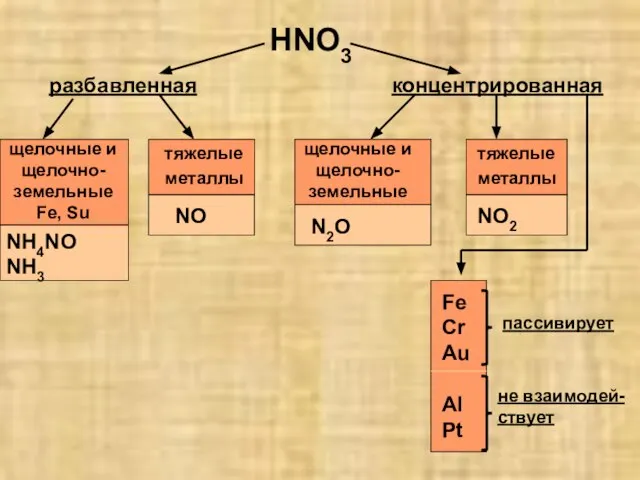
- 16. HNO3 разбавленная концентрированная щелочные и щелочно-земельные Fe, Su тяжелые металлы NH4NO NH3 NO щелочные и щелочно-земельные
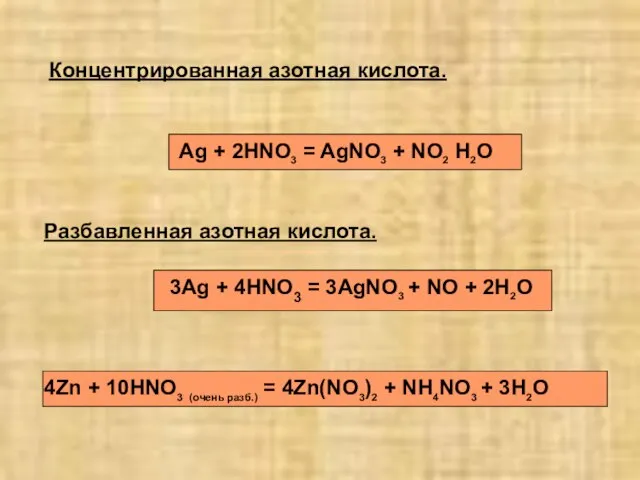
- 17. Разбавленная азотная кислота. Концентрированная азотная кислота. Ag + 2HNO3 = AgNO3 + NO2 H2O 3Ag +
- 18. Азотная кислота взаимодействует со многими неметаллами, окисляя их до соответствующих кислот: 3P + 5HNO3 + H2O
- 19. Нитраты – соли азотной кислоты, получают при действии кислоты на металлы, их оксиды и гидроксиды. Селитры
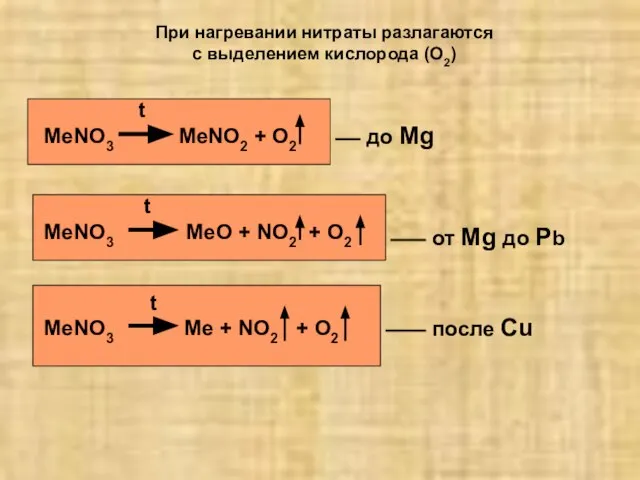
- 20. При нагревании нитраты разлагаются с выделением кислорода (O2) t MeNO3 MeNO2 + O2 t MeNO3 MeO
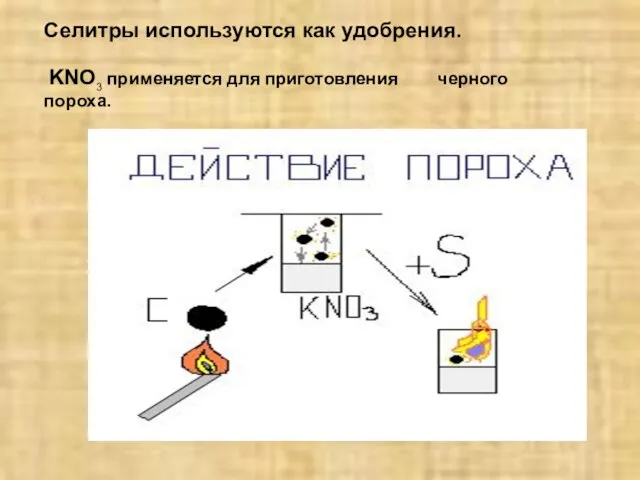
- 21. Селитры используются как удобрения. KNO3 применяется для приготовления черного пороха.
- 22. 1 Аммиак при нормальных условиях – это… 1) бесцветный газ без запаха 2) бурый, остро пахнущий
- 23. II вариант 1 азотная кислота – это сильная кислота, так как она… 1)полностью диссоциирована в водном
- 25. Скачать презентацию










 Химия вокруг нас. 10 класс
Химия вокруг нас. 10 класс Облик и габитус кристаллов
Облик и габитус кристаллов Гидролиз солей. Лекция №18
Гидролиз солей. Лекция №18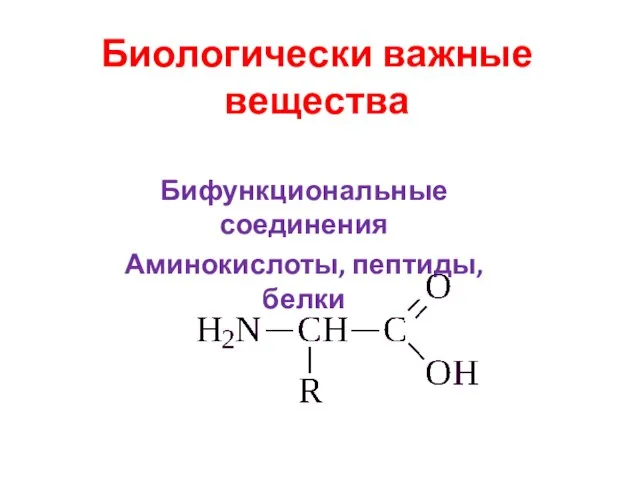 Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки
Биологически важные вещества. Бифункциональные соединения. Аминокислоты, пептиды, белки Л-1-4
Л-1-4 Химия цвета
Химия цвета Дисперсные системы
Дисперсные системы Стеклоткани. Виды стеклотканей
Стеклоткани. Виды стеклотканей Аллотропные модификации углерода
Аллотропные модификации углерода Технология растворов на неводных растворителях
Технология растворов на неводных растворителях Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов
Периодическая система химических элементов Д.И. Менделеева. Знаки химических элементов Металловедение
Металловедение Углеводороды
Углеводороды Общая характеристика неметаллов. 9 класс
Общая характеристика неметаллов. 9 класс Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Практико-ориентировочный проект Оксиды на службе у человека
Практико-ориентировочный проект Оксиды на службе у человека Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Взаимодействие элементов-неметаллов между собой. 8 класс
Взаимодействие элементов-неметаллов между собой. 8 класс Спирты (алканолы)
Спирты (алканолы) Ароматерапия
Ароматерапия Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Современные подходы к преподаванию химии
Современные подходы к преподаванию химии Синтез-газ
Синтез-газ Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Chemia kosmetyczna
Chemia kosmetyczna Карбоновые кислоты. Сложные эфиры. Жиры
Карбоновые кислоты. Сложные эфиры. Жиры Казанская химическая школа
Казанская химическая школа Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ
Фотографии к исследовательской работе в рамках конкурса УРАЛХИМиЯ