Содержание
- 2. Эпиграф: «Мощь и сила науки – во множестве фактов, цель – в обобщении этого множества». Д.И.
- 4. «Металлом называется твердое, непрозрачное и светлое тело, которое в огне плавится и холодное ковать можно». М.В.Ломоносов.
- 5. МЕТАЛЛЫ- ВОССТАНОВИТЕЛИ Атомы Ме имеют сравнительно большие радиусы поэтому электроны значительно удалены от ядра и слабо
- 6. КРИСТАЛЛИЧЕСКАЯ РЕШЕТКА Металлическая - в ее узлах находятся положительно заряженные ионы, а между ними свободно перемещаются
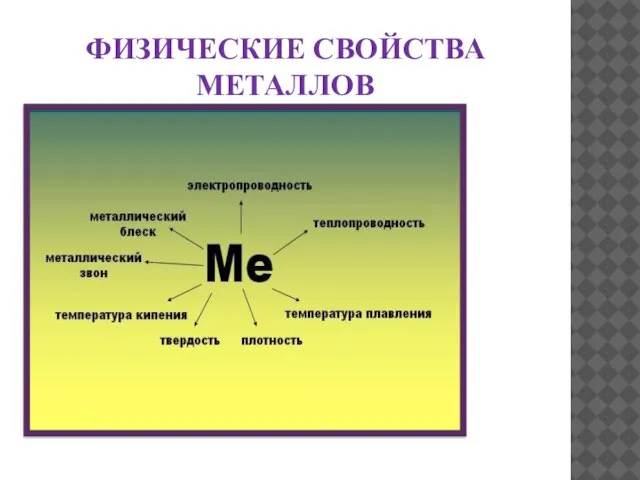
- 7. ФИЗИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- 8. АГРЕГАТНОЕ СОСТОЯНИЕ Все металлы твердые, исключение ртуть - единственный жидкий металл.
- 9. ТВЁРДОСТЬ Твердые: металлы сравниваются по твердости с алмазом, твердость которого равна 10. Хром — самый твердый
- 10. ТЕМПЕРАТУРА ПЛАВЛЕНИЯ Легкоплавкие (температура плавления до 1539°С).К самым легкоплавким металлам относятся: ртуть — температура плавления —39°С;
- 11. ПЛАСТИЧНОСТЬ Способность изменять свою форму при ударе, прокатываться в тонкие листы, вытягиваться в проволоку: золото, серебро,
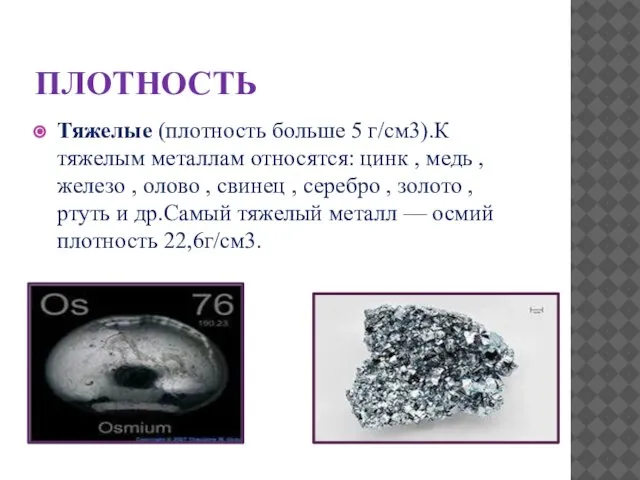
- 12. ПЛОТНОСТЬ Тяжелые (плотность больше 5 г/см3).К тяжелым металлам относятся: цинк , медь , железо , олово
- 13. ЭЛЕКТРОПРОВОДНОСТЬ Высокая электропроводность уменьшается в ряду металлов:Аg Сu Аu Аl Мg Zn Fе РЬ Hg
- 14. ТЕПЛОПРОВОДНОСТЬ Хорошая теплопроводность, уменьшается в ряду металлов: Аg Сu Аu Аl Мg Zn Fе РЬ Hg
- 15. МЕТАЛЛИЧЕСКИЙ БЛЕСК Световые лучи падают на поверхность металла и отталкиваются от неё свободными электронами, создавая эффект
- 16. Способность намагничиваться - железо, кобальт, никель. Находит применение при изготовлении магнитов.
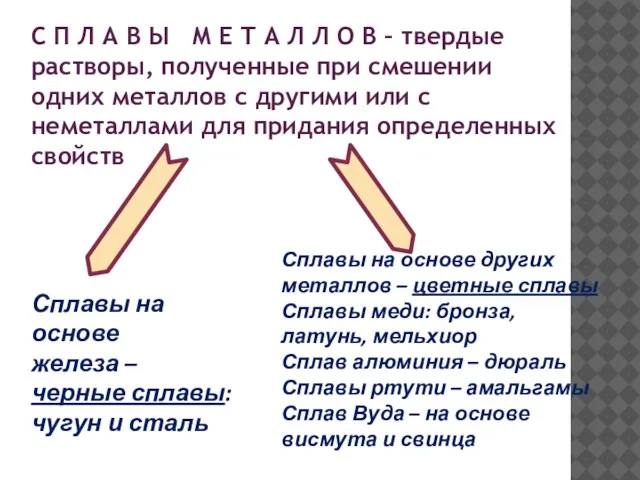
- 17. С П Л А В Ы М Е Т А Л Л О В – твердые
- 18. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ МЕТАЛЛОВ Пирометаллургический Гидрометаллургический Электрометаллургический Металлотермия
- 19. ПИРОМЕТАЛЛУРГИЧЕСКИЙ СПОСОБ Пирометаллургия- методы переработки руд, основанные на химических реакциях, происходящих при высоких температурах. 1 стадия:
- 20. ЭЛЕКТРОМЕТАЛЛУРГИЧЕСКИЙ СПОСОБ Электрометаллургия методы получения металлов, основанные на выделении металлов из растворов или расплавов их соединений
- 21. ГИДРОМЕТАЛЛУРГИЧЕСКИЙ СПОСОБ Гидрометаллургия- методы получения металлов, основанных на химических реакциях, происходящих в растворах: 1 стадия: перевод
- 23. Металлотермия II Металлотермия- метод получения металлов, основанный на выделении металлов из их оксидов более активными металлами
- 24. Тест «Металлы». Инструкция: выберите 1 правильный ответ, время выполнения 5 минут. Вариант 1. № Задание Варианты
- 25. Вариант 2. Задание Варианты ответов 1. Выберите группу элементов, в которой находятся только металлы а) Cu,
- 26. После выполнения теста сверьтесь с ответами. Если у вас нет ошибок, то поставьте «5», если одна
- 27. ФИЗМИНУТКА Теперь немного отдохнем, глазами поведем и в таблице Д.И.Менделеева найдем. (Переведите с химического на общепринятый
- 28. ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ Восстановительную активность металла в химических реакциях, протекающих в водных растворах, отражает его положение
- 29. ВЗАИМОДЕЙСТВИЕ МЕТАЛЛОВ С ПРОСТЫМИ ВЕЩЕСТВАМИ В общем виде можно выразить следующим образом: M0 + неM0 →
- 30. ВЗАИМОДЕЙСТВИЕ С ВОДОЙ Щелочные и щелочноземельные Ме ? ? Щелочи 0 +1 +1 0 2Na +
- 31. ВЗАИМОДЕЙСТВИЕ С КИСЛОТАМИ Mg + H2SO4 = MgSO4 + H2↑ Zn + H2SO4 = ZnSO4 +
- 32. Взаимодействие металлов с солями Fe + CuSO4 → Cu↓ +FeSO4 o 2+ o 2+ Fe +
- 33. УПРАЖНЕНИЕ Допишите практически осуществимые реакции: а) Fe + HCl → б) Ag + H3PO4 → в)
- 34. ЭКПЕРИМЕНТАЛЬНОЕ ЗАДАНИЕ 1. Распознать предложенные вещества: хлорид натрия, хлорид бария. Что является реактивом на соли бария?
- 35. Решить задачу: Чему равна масса практическая сульфата бария, который получен при взаимодействии 15г хлорида бария с
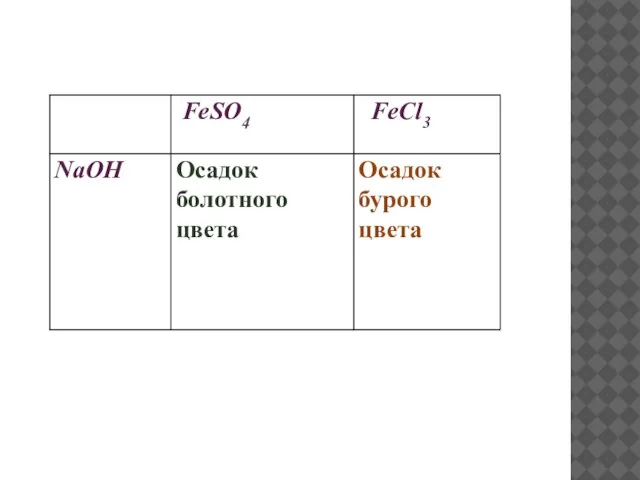
- 36. ЭКСПЕРИМЕНТАЛЬНАЯ ЗАДАЧА Доказать, что выданные вещества содержат ионы железа (II),ионы железа(III). Из реактивов имеется гидроксид натрия.
- 38. «Человек не может обойтись без металлов. Если бы не было металлов, люди бы влачили омерзительную жизнь
- 40. ГРАФИЧЕСКИЙ ДИКТАНТ
- 41. Вопросы графического диктанта 1.Является самым легким металлом. 2.Содержит 1 электрон на внешнем энергетическом уровне. 3.При горении
- 42. Критерии выставления оценок записаны на доске. Оценка «5» - нет ошибок Оценка «4» - допущена 1
- 43. РЕФЛЕКСИЯ. - Выполнили ли мы все поставленные задачи? (Слайд №3). - На сколько активно работал каждый
- 45. Скачать презентацию






































 Контроль знаний на уроках химии
Контроль знаний на уроках химии Истина - дочь времени, а не авторитета
Истина - дочь времени, а не авторитета Невидиме чорнило
Невидиме чорнило Кинетическая устойчивость комплексов
Кинетическая устойчивость комплексов Понятие о предельных углеводородах. Алканы
Понятие о предельных углеводородах. Алканы Обобщение свойств углеводородов
Обобщение свойств углеводородов Спирты
Спирты Химические реакции. Классификация
Химические реакции. Классификация Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии
Основные физические и химические величины. Элективный курс в 10 классе Решение задач по химии Молекула воды, какая ты?
Молекула воды, какая ты? Минерал гранат
Минерал гранат romanchuk
romanchuk Железо в продуктах питания
Железо в продуктах питания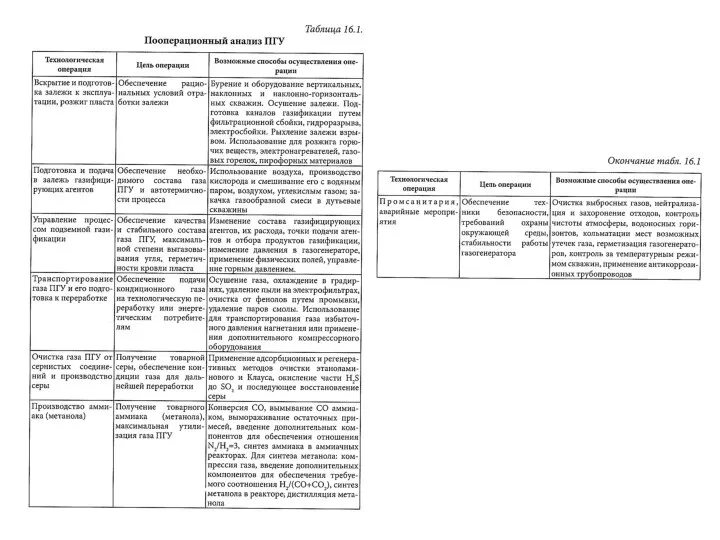 Пооперационный анализ ПГУ
Пооперационный анализ ПГУ Алгоритм решения задач по химии.
Алгоритм решения задач по химии. Условия хранения и подготовка скоропортящихся грузов к перевозкам
Условия хранения и подготовка скоропортящихся грузов к перевозкам Сера
Сера Химические реакции
Химические реакции Азотсодержащие. Амины (семинар)
Азотсодержащие. Амины (семинар) Інструктаж з БЖД. Особливості органічних сполук (порівняно з неорганічними). Вуглеводні. Метан
Інструктаж з БЖД. Особливості органічних сполук (порівняно з неорганічними). Вуглеводні. Метан Количество вещества
Количество вещества Железо и его сплавы
Железо и его сплавы Презентация
Презентация Образование растворов ВМС
Образование растворов ВМС Классификация неорганических соединений
Классификация неорганических соединений Алканы (строение и изомерия)
Алканы (строение и изомерия) Соли и их свойства
Соли и их свойства Оксиды в мире минералов
Оксиды в мире минералов