Содержание
- 2. H2
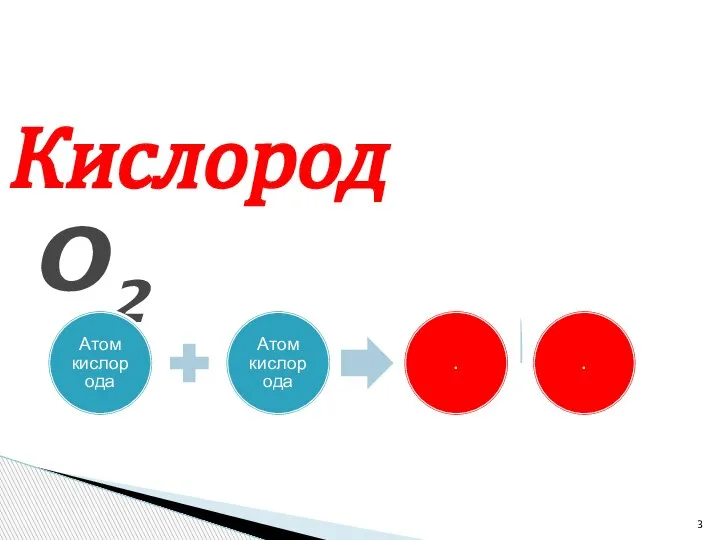
- 3. Кислород O2 Атом кислорода Атом кислорода . .
- 4. Цель: сравнить физические и химические свойства двух газов, способы их собирания и распознавания; способы получения газов
- 5. Характеристика химических элементов Распространение в природе Получение кислорода и водорода Физические свойства Химические свойства Применение План
- 6. . Даны формулы : H, O2, O, H2. Что означают данные записи?
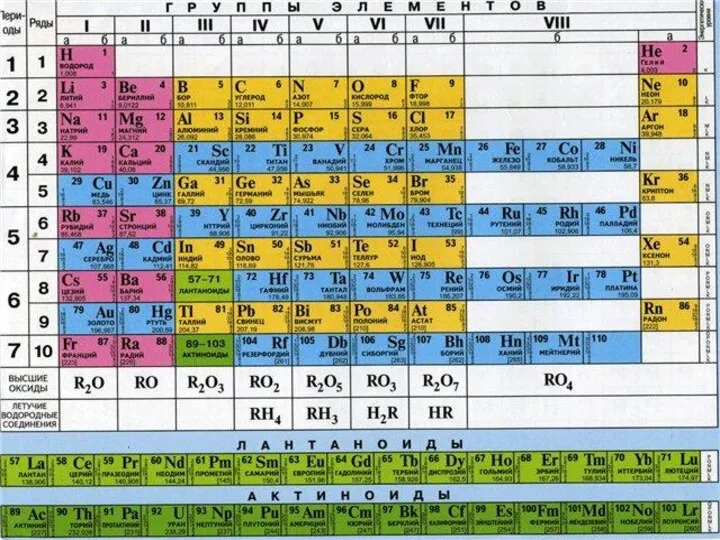
- 8. Группа I газа Н2 Группа II газа О2 Химический знак Ar( )= Валентность Самый распространенный элемент
- 9. КОДОВЫЙ ДИКТАНТ 1.Газ легче воздуха. 2.Малорастворимый газ в воде. 3.Этот газ хорошо поддерживает горение. 4.Выделяется в
- 10. 1774 г. – кислород открыт англ. химиком Джозефом Пристли путём разложения оксида ртути в герметично закрытом
- 11. 1766 г. – водород открыл Г. Кавендиш 1784 г. – А. Лавуазье назвал водород hydrogene (др.-греч.
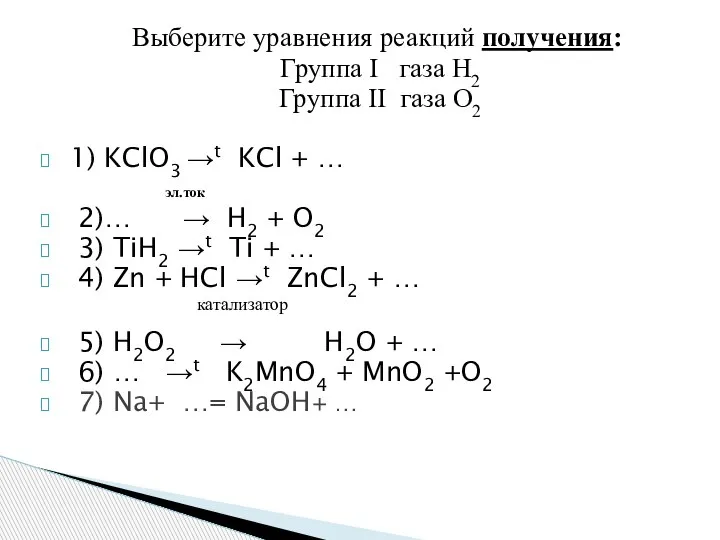
- 12. Выберите уравнения реакций получения: Группа I газа Н2 Группа II газа О2 1) KClO3 →t KCl
- 13. Получение водорода эл.ток 1)2H₂O → 2H2 ↑ + O2↑ 2) TiH2 →t Ti + H₂↑ 3)
- 14. Получение кислорода 1) 2KClO3 →t 2KCl + O2↑ эл. ток 2)2H₂O → 2H2 ↑ + O2↑
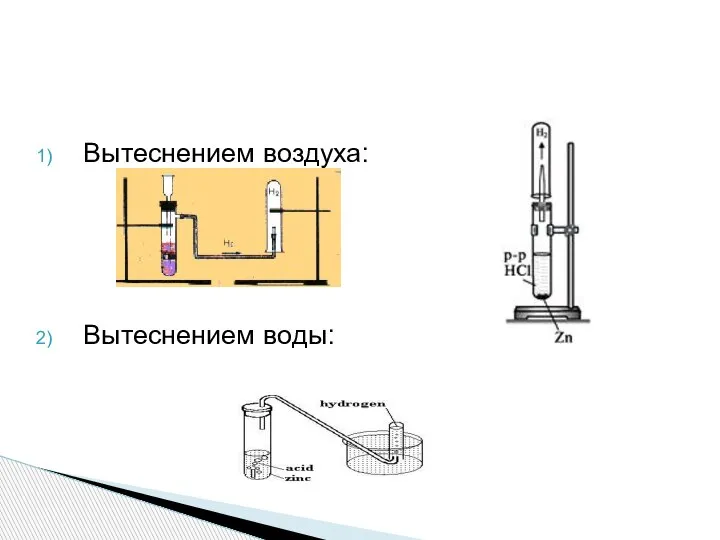
- 16. Вытеснением воздуха: Вытеснением воды:
- 17. Химические свойства кислорода Запишите уравнения реакций, о которых говориться в стихотворении: Известно, что горят отлично в
- 18. Химические свойства водорода Восстановление меди СuО + Н2 → Горение водорода Н2 + O2 → Взаимодействие
- 19. Горение магния, угля, серы, фосфора, железа и водорода 2Mg + O₂ → 2MgO C + O₂
- 20. Химические свойства водорода Восстановление меди СuО + Н2 → Сu + Н2O Горение водорода 2H2 +
- 21. Применение водорода Водород как топливо будущего При сгорании водорода выделяется большое количество теплоты, при этом не
- 22. Водород используется в производстве перекиси водорода и химических реагентов в водородной сварке в гидрировании растительных масел
- 25. Итог урока Выберите Ничего не понятно Есть вопросы Свой вариант Было скучно Довольна оценкой Узнал(а) много
- 27. Скачать презентацию




















 Коррозия Автор: Резванова Дарья Ученица 8 класса ГБОУ СОШ №484 Руководитель Бирюкова З.В. Учитель химии ГБОУ СОШ №484 г.Санкт – П
Коррозия Автор: Резванова Дарья Ученица 8 класса ГБОУ СОШ №484 Руководитель Бирюкова З.В. Учитель химии ГБОУ СОШ №484 г.Санкт – П Производство чугуна и стали
Производство чугуна и стали Полимеры
Полимеры Решение экспериментальных задач по теме Подгруппы азота и углерода
Решение экспериментальных задач по теме Подгруппы азота и углерода Основы общей химии
Основы общей химии Ювелирные камни
Ювелирные камни Фуллерены: аллотропы углерода
Фуллерены: аллотропы углерода Амины. Аминокислоты
Амины. Аминокислоты Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) Чистые вещества и смеси. Классификация веществ. Оксиды
Чистые вещества и смеси. Классификация веществ. Оксиды Неметаллы и их соединения
Неметаллы и их соединения Гидролиз солей
Гидролиз солей Электропроводность растворов и электрохимия
Электропроводность растворов и электрохимия Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии
Типичные ошибки, допускаемые учащимися при выполнении задания повышенного уровня сложности С-5 ЕГЭ по химии Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Алкины
Алкины Химические реакции. Подготовка к контрольной работе №2
Химические реакции. Подготовка к контрольной работе №2 Основы аналитической химии
Основы аналитической химии alkany
alkany Реакции окисления-восстановления в химическом анализе. (Лекция 7.2)
Реакции окисления-восстановления в химическом анализе. (Лекция 7.2) Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна.
Химия в космосе Автор: Гриб Яна ученица 8а класса школа №484. Научный руководитель: Бирюкова Зоя Владимировна. Набор для выращивания монокристалла. Защита проекта
Набор для выращивания монокристалла. Защита проекта Криптон. Самостоятельная работа
Криптон. Самостоятельная работа Парафины. Алканы
Парафины. Алканы ОВР
ОВР Радон (222Rn)
Радон (222Rn) Состав популярных напитков, рН-группа
Состав популярных напитков, рН-группа Разветвленные цепные реакции
Разветвленные цепные реакции