Слайд 2Цель работы
Рассмотреть влияние условий проведения процесса на результат реакции.
Научиться составлять окислительно –восстановительные

реакции и подбирать в них коэффициенты.
Слайд 3Теоретическое обоснование
Окислительно-
восстановительными (ОВР)
называются такие реакции, в результате
которых изменяется степень окисления
одного

или нескольких элементов,
входящих в состав реагирующих веществ.
Слайд 4Теоретическое обоснование
Процесс отдачи электронов, сопровождающийся
повышением степени окисления элемента,
называется окислением.
Присоединение электронов, сопровождающееся

понижением степени окисления элемента,
называется восстановлением.
Вещество, в состав которого входит окисляющийся
элемент, называется восстановителем, а вещество,
содержащее восстанавливающийся элемент, окислителем.
Действие и исполнитель – называются разными словами!!!
Слайд 5Теоретическое обоснование
Степень окисления элемента в
соединении определяется как число
электронов, смещённых от атома

данного
элемента к другим атомам
(положительная степень окисления) или
смещённых от других атомов к атому
данного элемента (отрицательная
степень окисления).
Слайд 6Теоретическое обоснование
Таким образом, окислитель в окислительно-восстановительной реакции восстанавливается, а восстановитель –

окисляется.
Окисление - восстановление – это единый, взаимосвязанный процесс.
Слайд 7Для подбора коэффициентов в ОВР
Отмечаем, что заданное уравнение реакции указывает на взаимодействие

реагирующих веществ в водном растворе :
KMnO4 + KI + H2SO4 →
→ K2SO4 + MnSO4 + I2 + H2O
Слайд 8Подбор коэффициентов в ОВР
2. Следовательно, рассматриваем, как эти вещества диссоциируют в водном

растворе:
K+ + MnO4- + K+ + I- + 2 H+ +
SO42- → K+ + SO42- + Mn2+ +
SO42- + I2 + H2O
Слайд 9Подбор коэффициентов в ОВР
3. Отмечаем: изменившиеся частицы и среду рабочего раствора
K+ +
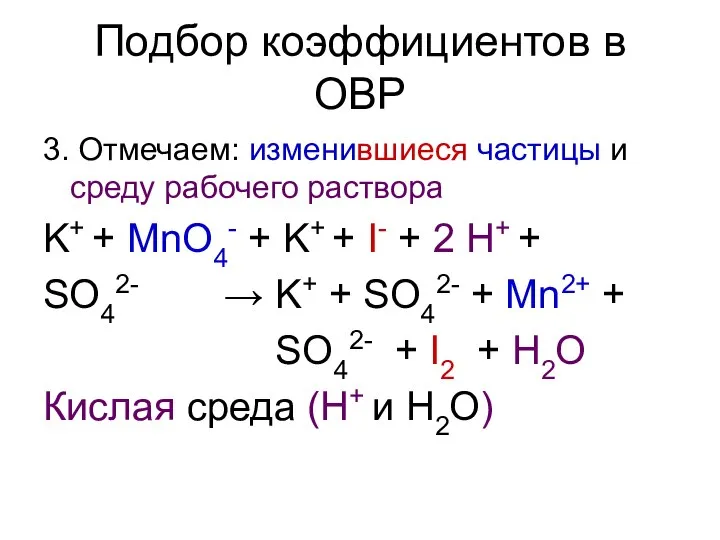
MnO4- + K+ + I- + 2 H+ +
SO42- → K+ + SO42- + Mn2+ +
SO42- + I2 + H2O
Кислая среда (Н+ и Н2О)
Слайд 10Подбор коэффициентов в ОВР
Рассматриваем: КАК менялись
частицы
MnO4- + 8 H+ + 5

ē → Mn2+ + 4 H2O
Процесс восстановления ,
MnO4- - окислитель.
Слайд 11Подбор коэффициентов в ОВР
4. Рассматриваем: КАК менялись
частицы
I- - ē →

I2
2 I- - 2 ē → I2
Процесс окисления, I- - восстановитель.
Слайд 12Подбор коэффициентов в ОВР
5. Уравниваем число передаваемых электронов (число отданных равно числу

принятых – материальный баланс)
MnO4- + 8 H+ + 5 ē → Mn2+ + 4 H2O 2
2 I- - 2 ē → I2 5
Итог: 2 MnO4- + 16 H+ + 10 I- =
2 Mn2+ + 8 H2O +5 I2
Слайд 13Подбор коэффициентов в ОВР
6. Переносим полученные коэффициенты в исходное уравнение:
2 KMnO4 +

10 KI + 8 H2SO4 →
→ K2SO4 + 2 MnSO4 + 5 I2 + 8 H2O
Слайд 14Подбор коэффициентов в ОВР
7. Проверяем, уравнены ли другие частицы:
2 KMnO4 + 10

KI + 8 H2SO4 =
= 6 K2SO4 + 2 MnSO4 + 5 I2
+ 8 H2O
Слайд 15Теоретическое обоснование
Условия возможности ОВР
∆G ˂ 0
φок ˃ φвосст
В справочниках
окисленная + nē

↔ восстановленная
форма форма
Значит уравнение для восстановителя
«переворачиваем».
Слайд 16Ход работы
Опыт 1. Превращение перманганата
калия в различных средах.
Посмотреть видео и составить

уравнения
реакций.
Оценить по величинам потенциалов в
какой среде перманганат более активен
как окислитель.
Слайд 17ОПЫТ № 2
Окислительно-восстановительная двойственность пероксида водорода.
Смотрим видео, отмечаем наблюдения, записываем уравнения проведённых

реакций.
Слайд 18Ход работы
Опыт 3. На основании справочных данных величин электродных потенциалов подобрать реагенты

для ОВР
Слайд 19Справочные данные
Cr2O72- + 14 H+ + 6 ē ↔ 2 Cr3+ +

7 H2O
φo = 1,33 В
I2 + 2 ē ↔ 2 I- φo = 0,513 В
Слайд 20Cr2O72- + 14 H+ + 6 ē ↔ 2 Cr3+ + 7
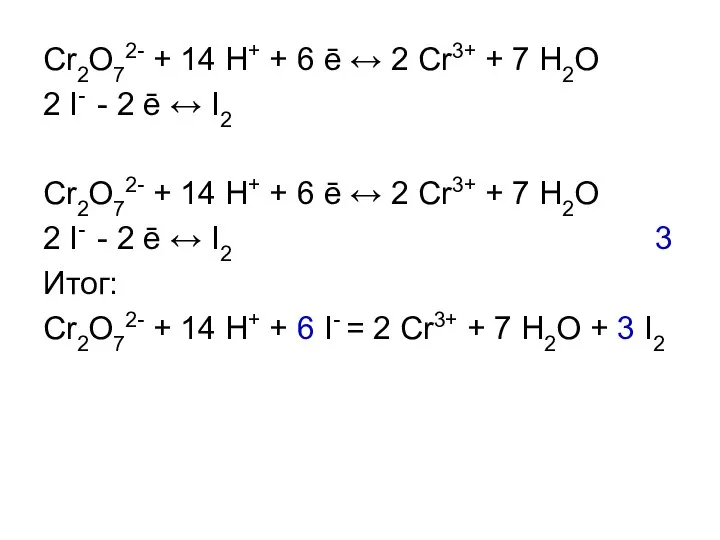
H2O
2 I- - 2 ē ↔ I2
Cr2O72- + 14 H+ + 6 ē ↔ 2 Cr3+ + 7 H2O
2 I- - 2 ē ↔ I2 3
Итог:
Cr2O72- + 14 H+ + 6 I- = 2 Cr3+ + 7 H2O + 3 I2
Слайд 21Выбираем реактивы
На полочкe расставлены склянки с растворами веществ
NaCl KI K2CrO4 HCl
K2Cr2O7 H2SO4
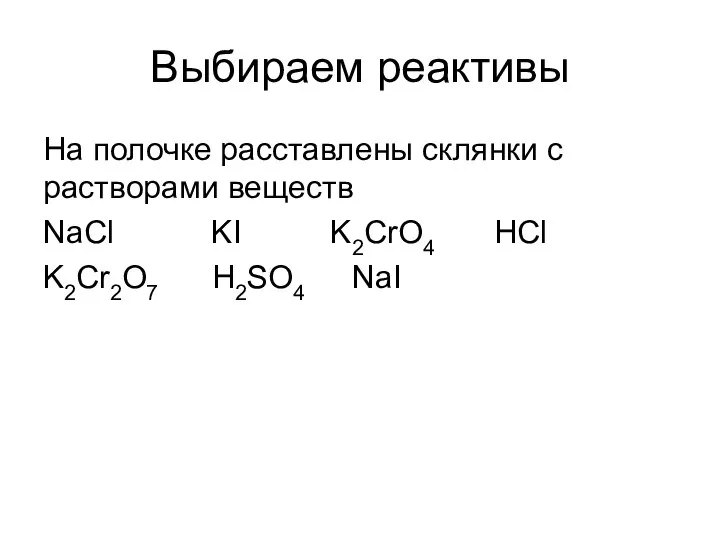
NaI
Слайд 22Проводим реакцию
Записываем уравнение реакции





















 Металлы. Своя игра
Металлы. Своя игра α-Аминокислоты
α-Аминокислоты Ионные уравнения реакций
Ионные уравнения реакций Жиры. Сложные эфиры
Жиры. Сложные эфиры Заполни электронные уровни элементов
Заполни электронные уровни элементов Презентация на тему Расчеты по химическим уравнениям
Презентация на тему Расчеты по химическим уравнениям  Презентация по Химии "Строении атомов. Химическая связь"
Презентация по Химии "Строении атомов. Химическая связь"  8-11 2 валентность
8-11 2 валентность Кислоты и соли
Кислоты и соли Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Презентация по химии на тему _Закон постоянства со
Презентация по химии на тему _Закон постоянства со Кипение. Испарение
Кипение. Испарение Презентация на тему Щелочные и щелочноземельные металлы
Презентация на тему Щелочные и щелочноземельные металлы  Ковалентная неполярная связь
Ковалентная неполярная связь Презентация на тему Железо и его соединения
Презентация на тему Железо и его соединения  Круговорот серы в природе
Круговорот серы в природе Подготовка к ГИА по химии
Подготовка к ГИА по химии Карбонаты. Лекция 12
Карбонаты. Лекция 12 Углерод. Положение в ПС и особенности строения атома
Углерод. Положение в ПС и особенности строения атома Строение и химический состав костей, рост костей
Строение и химический состав костей, рост костей Характеристика элемента по его положению в периодической системе
Характеристика элемента по его положению в периодической системе Основания: определение, классификация, химические свойства
Основания: определение, классификация, химические свойства Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Презентация на тему Металлы и неметаллы
Презентация на тему Металлы и неметаллы  Лекарственные средства – производные пиримидина
Лекарственные средства – производные пиримидина карбоновые кислоты
карбоновые кислоты Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов
Металлы и неметаллы. Ознакомление с общими физическими свойствами металлов и неметаллов Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5
Адсорбция. Механизмы адсорбции. Термодинамика адсорбции. Лекция 5