Содержание
- 5. Массовое число A = Np + Nn; Np - число протонов в ядре; Nn - число
- 6. Z – формальный заряд ядра, номер элемента в Периодической системе элементов Массовое число A = Np
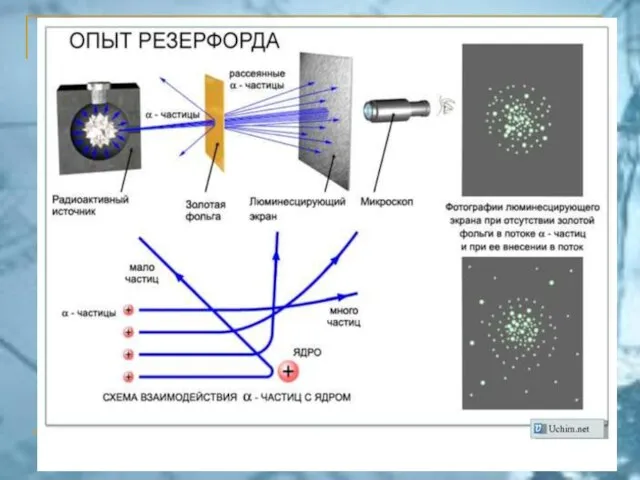
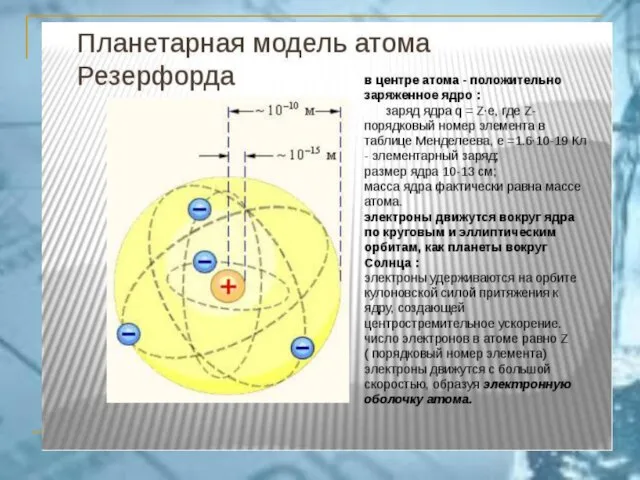
- 10. Постулаты Бора 1) В атоме существуют орбиты, двигаясь по которым, электрон не излучает. Они называются стационарными.
- 11. 3) Стационарными являются орбиты, для которых выполняется условие где m – масса электрона, v– скорость вращения,
- 12. Французский физик-теоретик, один из основоположников квантовой механики, лауреат Нобелевской премии по физике за 1929 год.
- 13. m – масса частицы; me = 9,11·10-31 кг v – скорость частицы λ - длина волны
- 14. Вернер Карл Гейзенберг (Werner Karl Heisenberg) 1901 — 1976 Немецкий физик-теоретик, один из создателей квантовой механики,
- 16. Принцип неопределённости Гейзенберга Невозможно одновременно точно определить импульс и координаты (время и энергию) микрочастицы Δp·Δx ≥
- 17. Эрвин Рудольф Йозеф Александр Шрёдингер (Erwin Rudolf Josef Alexander Schrödinger) 1887 — 1961 Австрийский физик-теоретик, один
- 18. Уравнение Шрёдингера или Ψ - волновая функция E – полная энергия U – потенциальная энергия ∇
- 19. Электрон в атоме является стоячей волной (его состояние не зависит от времени). Он представляет собой облако
- 20. Уравнение Шрёдингера Уравнение Шрёдингера имеет множество решений в виде комбинаций Ψi и Ei Каждая волновая функция
- 22. Модель атома водорода Точное решение уравнения Шрёдингера для атома водорода даёт множество волновых функций Ψi –
- 24. Квантовые числа n – главное квантовое число; оно определяет размеры электронного облака и энергию электрона n
- 25. Характеристика квантовых чисел
- 26. Орбитальное квантовое число и форма электронного облака
- 27. s-АО и p-АО s-АО: l = 0, ml = 0 p-АО l = 1, ml =
- 28. d-АО (l = 2) dxy, ml = 2 dxz, ml = -1 dyz, ml = 1
- 29. f-АО (l = 3) ml = -3 ml = -2 ml = -1 ml = 0
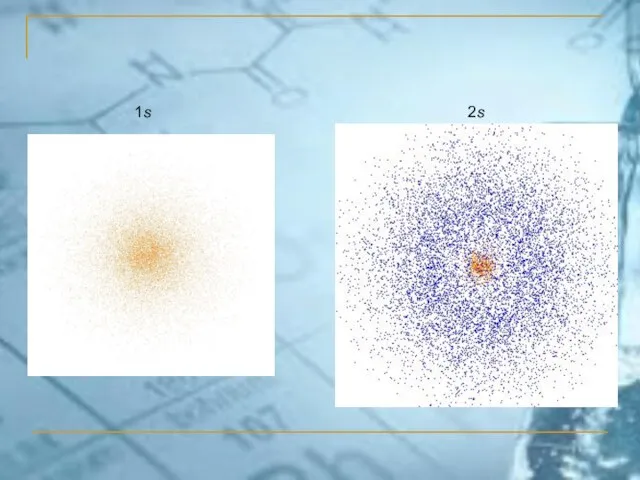
- 30. 1s 2s
- 31. Многоэлектронные атомы Многоэлектронные атомы имеют 2 и более электронов Уравнение Шрёдингера решается приближённо Электроны занимают различные
- 32. Многоэлектронные атомы Каждый электронный слой состоит из электронных оболочек
- 33. Многоэлектронные атомы Каждая электронная оболочка состоит из квантовых ячеек – орбиталей, в зависимости от числа магнитных
- 35. Состояние электрона в многоэлектронном атоме Чем больше n, тем больше энергия электрона (больше размер электронного облака,
- 36. Заполнение атомных орбиталей электронами в многоэлектронном атоме Принцип наименьшей энергии Принцип Паули Правило Хунда
- 37. Принцип наименьшей энергии Атом стремится к минимуму энергии. Электроны заполняют АО с увеличением энергии (с увеличением
- 38. Клечковский Всеволод Маврикиевич (1900 – 1972) Ввёл представление о (n + l)-областях электронных состояний в атомах
- 41. Вольфганг Эрнст Паули (Wolfgang Ernst Pauli), 1900-1958 С именем Паули связано такое фундаментальное понятие квантовой механики,
- 42. Принцип Паули (принцип запрета) В атоме не может быть двух электронов с одинаковым набором четырёх квантовых
- 43. 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s,
- 44. Число электронов в электронных оболочках атома Максимальное число электронов в электронной оболочке Nl определяется орбитальным квантовым
- 45. Число электронов в электронных слоях атома Максимальное число электронов в электронном слое Nn определяется главным квантовым
- 46. Фридрих Хунд (Friedrich Hund) 1896 — 1997 Немецкий физик. Основные труды по квантовой механике, спектроскопии, магнетизму
- 47. Правило Хунда Модуль суммарного значения спинового квантового числа электронов данной электронной оболочки должен быть максимальным Правило
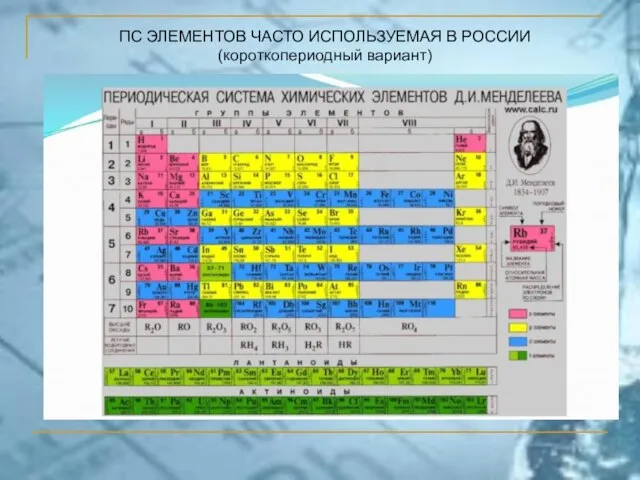
- 50. ПС ЭЛЕМЕНТОВ ЧАСТО ИСПОЛЬЗУЕМАЯ В РОССИИ (короткопериодный вариант)
- 79. Скачать презентацию
























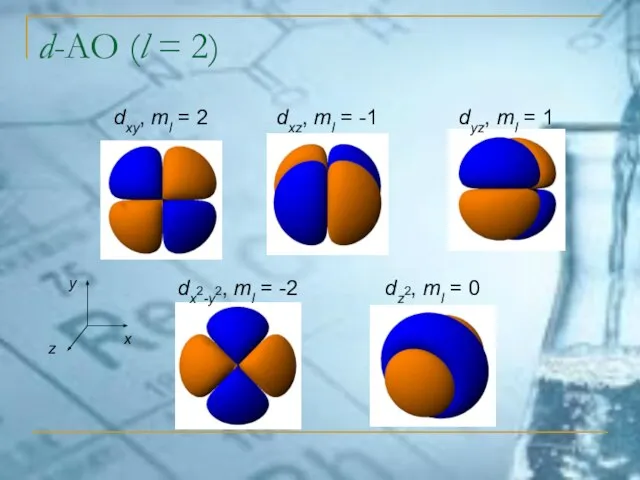











































 Органические вещества
Органические вещества Модель Андерсона
Модель Андерсона Презентация на тему Сплавы металлов (9 класс)
Презентация на тему Сплавы металлов (9 класс)  Бордос сұйықтығын дайындау және оның сапасын тексеру
Бордос сұйықтығын дайындау және оның сапасын тексеру Презентация на тему Применение кислорода
Презентация на тему Применение кислорода  Теория валентных связей
Теория валентных связей Метаболизм липидов
Метаболизм липидов Методи визначення корозійної стійкості матеріалів (тема 11)
Методи визначення корозійної стійкості матеріалів (тема 11) Ионные уравнения
Ионные уравнения Биохимия крови
Биохимия крови Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Химическая связь в органических соединениях
Химическая связь в органических соединениях Спирты и фенолы
Спирты и фенолы Химические свойства и получение насыщенных одноатомных спиртов
Химические свойства и получение насыщенных одноатомных спиртов Khim_8
Khim_8 Предельные одноатомные спирты
Предельные одноатомные спирты Аминокислоты. Пептиды. Белки. Тема 2
Аминокислоты. Пептиды. Белки. Тема 2 Презентация на тему по химии витамины
Презентация на тему по химии витамины  Астат. Свойства астата
Астат. Свойства астата Якісні реакції органічних речовин
Якісні реакції органічних речовин Степень окисления
Степень окисления Кетоны
Кетоны Сложные реакции
Сложные реакции Обратимость химических реакций. Химическое равновесие
Обратимость химических реакций. Химическое равновесие Сходство химического состава клеток разных организмов как доказательство их родства
Сходство химического состава клеток разных организмов как доказательство их родства Свойства веществ
Свойства веществ Конструирование макромолекул методом ATRP
Конструирование макромолекул методом ATRP Применение алканов
Применение алканов