Содержание
- 2. Титрование 1. Понятие о титре 2. Работа с пипетками 3. Работа с бюретками 4. Индикаторы 5.
- 3. Титрование - определение количества вещества или точной концентрации раствора (титра) объемно-аналитическим путем. В основе титрометрических определений
- 4. В основе титрования лежат химические реакции, которые должны удовлетворять ряду требований
- 5. Реакция должна проходить количественно по определенному уравнению без побочных реакций, т.е. прибавляемый реактив должен расходоваться исключительно
- 6. Окончание реакции должно точно фиксироваться, чтобы количество реактива было эквивалентно количеству определяемого вещества. На эквивалентности реагирующих
- 7. Реакция должна протекать с достаточной скоростью и быть практически необратимой.
- 8. Методы титрометрического анализа 1.Кислотно-основные методы 2. Методы окислительно-востановительные (оксидиметрии). 3.Методы осаждения и комплексообразования
- 9. Кислотно-основные методы, в основании которых лежит реакция нейтрализации. Этим методом определяют количество кислот, оснований и некоторых
- 10. Методы окислительно-восстановительные (оксидиметрии). Основана на реакциях окислительного восстановления. При помощи растворов окислителей определяют содержание восстановителей и
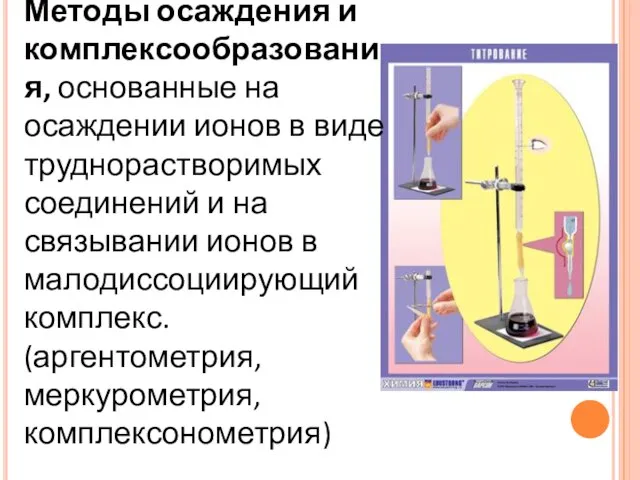
- 11. Методы осаждения и комплексообразования, основанные на осаждении ионов в виде труднорастворимых соединений и на связывании ионов
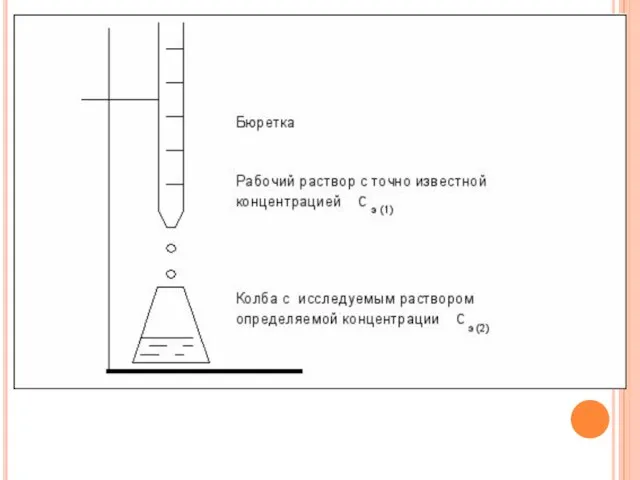
- 12. 1)рабочий раствор – тот раствор которым проводят титрование его концентрация известна; 2)титруемый раствор, концентрация которого неизвестна.
- 13. Работа с пипетками Для отмеривания титруемого раствора применяют пипетку Мора или градуированную пипетку. Пипетки д.б. идеально
- 14. Работа с бюретками Бюретки д.б. тщательно вымыты и отрегулированы. Перед заполнением бюретку промывают раствором, которым будут
- 16. Индикаторы Для установления точки эквивалентности, т.е. момента, когда заканчивается реакция между рабочим раствором и титруемым растворами
- 17. Индикаторы могут быть: -внутренними, когда индикатор добавляют в титруемый раствор перед титрованием. -внешними, когда по мере
- 18. Техника титрования
- 19. 1.Размер колбы или стакана, в котором проводиться титрование, д.б. таким, чтобы объем жидкости в конце титрования
- 20. 4.Колбу держат в правой руке и вращательными движениями перемешивают раствор 5.Левой рукой открывают и закрывают кран
- 22. 7.Результат титрования записывают до второго десятичного знака. 8.Для точности исследования необходимо проводить 3 параллельных титрования. При
- 23. Установление титра рабочего раствора Рабочий раствор тот, который расходовался для титрования. Необходимо точно знать его точную
- 24. Для приготовления рабочего раствора существуют 2 метода: 1.Растворы с приготовленным титром - растворяют точную навеску и
- 25. 2.Растворы с установленным титром - раствор готовят примерно нужной концентрации, а точную концентрацию определяют титрованиями, получается
- 26. Два способа установки титра. 1.По навеске – это более точный способ. На аналитических весах будут три
- 27. 2.По точному раствору – берется определенный объем исходного раствора, приготовленного из фиксанала. По результатам титрования устанавливают
- 28. Приготовление растворов из фиксаналов Фиксанал — стеклянная ампула, содержащая строго отмеренное количество вещества.
- 30. Расчеты при титровании Вычисление точной N-ой концентрации Поправочный коэффициент К Вычисление титра Вычисление массы определяемого вещества
- 31. 1.Вычисление точной N-ой концентрации: Нормальность подсчитывается до 4-го десятичного знака
- 32. Пример: определить N-ую концентрацию HCl, если на титрование пошло 10,0 мл раствора HCl пошло: а)10,25мл б)10,27мл
- 33. 2. Для вычисления точной N-ой концентрации часто применяют поправочный коэффициент К. Это величина, на которую умножают
- 34. Например, предполагали, что концентрация титруемого раствора будет 0,1n, а при титровании определена концентрация = 0,0945н N-концентрация
- 35. 3. Вычисление титра Концентрацию рабочего раствора часто выражают в виде титра по определенному веществу. Титр -
- 36. Для расчетов применяется формула: где: х-рабочий раствор, у-определяемое в-во
- 37. Например, дан рабочий раствор AgNO3 c N=0.1020n ЭCl=35.45 Следовательно, титр AgNO3 по Cl равен Столько г
- 38. 4. Вычисление массы определяемого вещества где: Ру-масса определяемого вещества Vх – объем определяемого вещества Тх/у –
- 39. Например, какое количество Cl содержалось в титруемом хлориде, если на титрование пошло 8,2 мл AgNO3? РCl=8,2*0,0036=0,02965г.
- 41. Скачать презентацию



































 Титриметрический анализ. Основные понятия
Титриметрический анализ. Основные понятия Узагальнення знань з теми Вуглеводні
Узагальнення знань з теми Вуглеводні Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор
Презентация на тему Характеристика элементов VII группы главной подгруппы. Хлор  Электрические явления на поверхности раздела фаз. Лекция 8
Электрические явления на поверхности раздела фаз. Лекция 8 Вторичная переработка нефти. Риформинг
Вторичная переработка нефти. Риформинг Сера
Сера obschaya_kharakteristika_prostykh_alifaticheskikh_efirov
obschaya_kharakteristika_prostykh_alifaticheskikh_efirov Таблица Д.И. Менделеева
Таблица Д.И. Менделеева Химическая викторина
Химическая викторина Чугуны
Чугуны Кислые горные породы
Кислые горные породы Практико-ориентированные задачи по химии для студентов гуманитарных специальностей
Практико-ориентированные задачи по химии для студентов гуманитарных специальностей Свойства воды
Свойства воды Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем
Качественные реакции на ионы металлов Работа выполнена учеником 9-го класса Бердинских Андреем Сера - химический элемент и простое вещество
Сера - химический элемент и простое вещество Практические занятия по теме: Методы защиты энергооборудования от коррозии (1)
Практические занятия по теме: Методы защиты энергооборудования от коррозии (1) Основные принципы работы химических сенсоров
Основные принципы работы химических сенсоров Кристаллография
Кристаллография Серная кислота H2SO4
Серная кислота H2SO4 Химия в жизни человека
Химия в жизни человека Презентация на тему Альдегиды и Кетоны
Презентация на тему Альдегиды и Кетоны  Химия и война
Химия и война Белки молока и молочных продуктов. Виды белков
Белки молока и молочных продуктов. Виды белков Полиморфизм кристаллов изатина
Полиморфизм кристаллов изатина Выберите вещества
Выберите вещества Теория химического строения А. М. Бутлерова
Теория химического строения А. М. Бутлерова Презентация на тему Решение задач "выход продукта от теоретически возможного"
Презентация на тему Решение задач "выход продукта от теоретически возможного"  Интеллектуальная игра по химии Металлы
Интеллектуальная игра по химии Металлы