Слайд 2Цели урока:
1. Сформировать представление о химическом уравнении.
2. Начать формировать умение составлять

уравнения химических реакций.
Слайд 3Проверка домашнего задания
1. Какие явления называются химическими?
2. Внешние признаки химических реакций.
3.Сформулируйте закон

сохранения массы веществ.
Работа на карточках.
Слайд 5Атомно-молекулярная теория
Молекулы состоят из атомов.
Атомы при химических реакциях не изменяются

и не исчезают, происходит лишь их перегруппировка, т.е. образуются новые вещества.
Следовательно, их общая масса также не изменяется
Слайд 6Основные правила составления химических уравнений:
1. В левой части уравнения пишутся формулы веществ,

вступающих в реакцию – исходные вещества.
2. В правой части – формулы получившихся веществ – продукты реакции.
3. Между исходными веществами и продуктами реакции ставится стрелка.
4. На основании закона сохранения веществ уравниваются атомы.
5.Число атомов каждого элемента в правой части равно числу атомов этого же элемента в левой части.
6. Уравнивание атомов производится с помощью подбора коэффициентов перед формулами веществ.
Слайд 7Химическим уравнением называют условную запись химической реакции с помощью химических формул и

математических знаков.
Слайд 8При разложении воды образуются два газообразных вещества - Н2 и О2.
H2O H2

+ O2
2H2O == 2H2 + O2
Уравнение химической реакции
Слайд 9Алгоритм составления уравнения химической реакции
1. Записать формулы исходных веществ.
2. Справа от формул

исходных веществ (после стрелки) записать формулы продуктов реакции.
3. Расставить коэффициенты.
Слайд 10Горение магния
Mg + O2 MgO
2Mg + O2 = 2MgO

Слайд 11Работа у доски
1. Получение углекислого газа:
С + О2
2. Разложение ртути:
HgO
3.
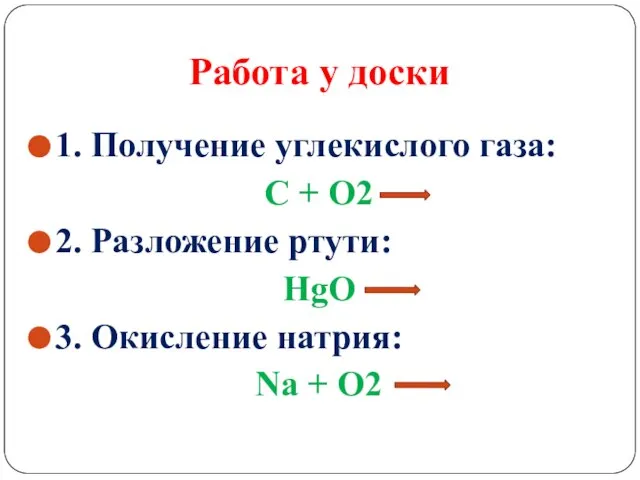
Окисление натрия:
Na + O2
Слайд 12Соотношение количеств веществ, участвующих в реакции.
Коэффициенты показывают не только число молекул каждого

вещества, но и соотношение количеств веществ, которые участвуют в реакции.
Например: 2Н2 + О2 = 2Н2О
Для образования воды(2 моль) необходимо столько же моль водорода(2 моль) и в 2 раза меньше кислорода (1 моль)
Слайд 13Задача:
Определить количество вещества кислорода, образующегося в результате разложения 4 моль воды.
Алгоритм решения

задачи:
1. Составить уравнение реакции.
2. Составить пропорцию, определив количества веществ по уравнению реакции и по условию, неизвестное берем за Х.
3. Составить уравнение (из пропорции).
4. Решить уравнение, найти Х.
Слайд 14Задача:
Какое количество кислорода потребуется для полного сгорания 3 моль меди?
Ответ: n

(О2) = 1,5 моль
Слайд 15Что мы узнали нового?
1. Химическим уравнением называют условную запись химической реакции с

помощью химических формул и математических знаков.
2. В левой части уравнения пишутся формулы веществ, вступающих в реакцию – исходные вещества.
3. В правой части – формулы получившихся веществ – продукты реакции.
4. На основании закона сохранения веществ уравниваются атомы.
5. Коэффициенты показывают не только число молекул каждого вещества, но и соотношение количеств веществ, которые участвуют в реакции.














 Строение и физические свойства металлов
Строение и физические свойства металлов Биологическая роль III(A) группы
Биологическая роль III(A) группы Валентность. Что же это такое?
Валентность. Что же это такое?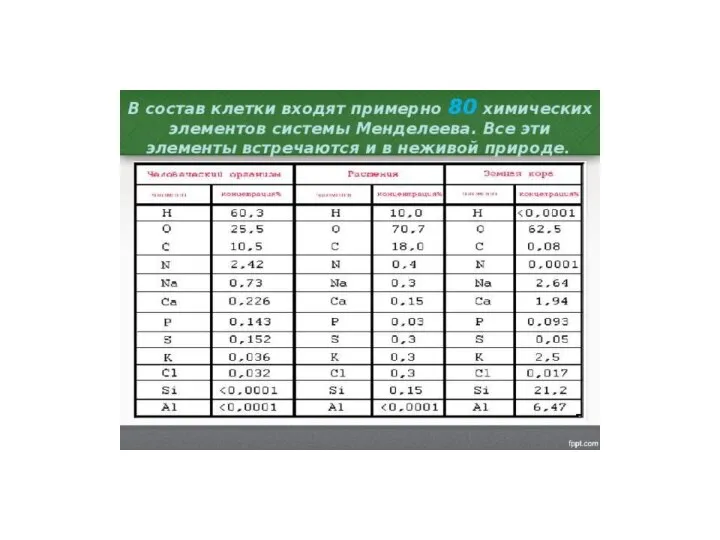 Состав клетки
Состав клетки Жиры, их строение, свойства и применение
Жиры, их строение, свойства и применение Материаловедение. Строение металлических материалов. Металлические сплавы
Материаловедение. Строение металлических материалов. Металлические сплавы Изучение свойств анилина. Лабораторная работа №18
Изучение свойств анилина. Лабораторная работа №18 Разнообразие жизни на Земле - Презентация_
Разнообразие жизни на Земле - Презентация_ Продолжение истории: 1933 год, Ленинград (Питер)
Продолжение истории: 1933 год, Ленинград (Питер) Смеси: гетерогенные, гомогенные
Смеси: гетерогенные, гомогенные Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Степень окисления
Степень окисления Основы химии полимеров
Основы химии полимеров Тренажер. Химические свойства солей
Тренажер. Химические свойства солей Презентация на тему Мыло. Синтетические моющие средства
Презентация на тему Мыло. Синтетические моющие средства  Строение и свойства циклоалканов
Строение и свойства циклоалканов Биодизельное топливо
Биодизельное топливо Соли: классификация, получение, номенклатура
Соли: классификация, получение, номенклатура Классификация химических реакций
Классификация химических реакций Средства для мытья окон
Средства для мытья окон Алхимики в Средние века
Алхимики в Средние века Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Многоатомные спирты
Многоатомные спирты Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Амфотерные оксиды и гидроксиды Неметаллы. Агрегатные состояния неметаллов
Неметаллы. Агрегатные состояния неметаллов proekt_TTU_15 (1)
proekt_TTU_15 (1) Атомы. Нахождение в природе
Атомы. Нахождение в природе Кремний и его соединения
Кремний и его соединения