Содержание
- 2. Истинным раствором или раствором называется устойчивая гомогенная система переменного количественного состава, состоящая из двух или более
- 3. Сходство растворов с химическими соединениями: 1. Однородность; 2. Выделение теплоты при растворении некоторых веществ Различия растворов
- 4. По растворимости в воде вещества делят на три группы: 1) Хорошо растворимые (р). Растворимость веществ больше
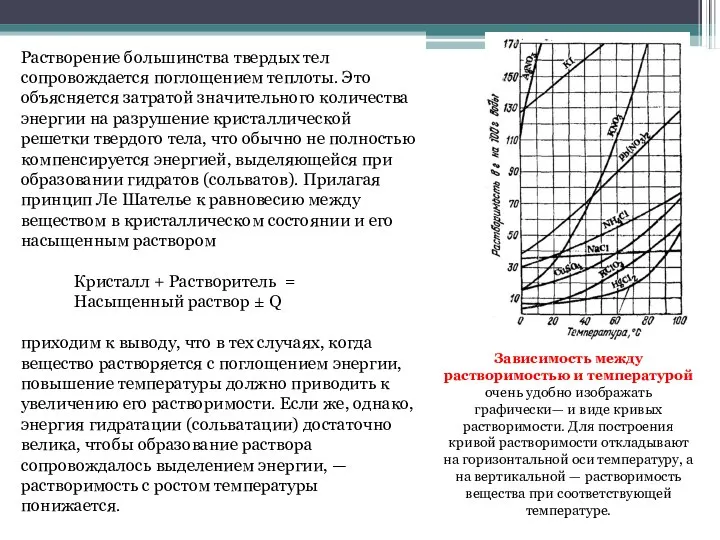
- 5. Растворение большинства твердых тел сопровождается поглощением теплоты. Это объясняется затратой значительного количества энергии на разрушение кристаллической
- 6. При растворении твердых тел в воде объем системы изменяется незначительно. Поэтому растворимость веществ, находящихся в твердом
- 7. Закон Генри: Масса газа, растворяющегося при постоянной температуре в данном объеме жидкости, прямо пропорциональна парциальному давлению
- 8. Произведение растворимости Насыщенный раствор находится в равновесии с твердой фазой растворяемого вещества. Гетерогенное равновесие «осадок насыщенный
- 9. Следовательно, для насыщенного водного раствора малорастворимого электролита произведение равновесных молярных концентраций его ионов в степенях, равных
- 10. Отсюда вытекают условия образования и растворения осадка: 1) если [An+]m·[Bm-]n = ПРAmBn, то осадок находится в
- 11. Насыщенными растворами приходится пользоваться сравнительно редко. В большинстве случаев употребляют растворы ненасыщенные, т.е. с меньшей концентрацией
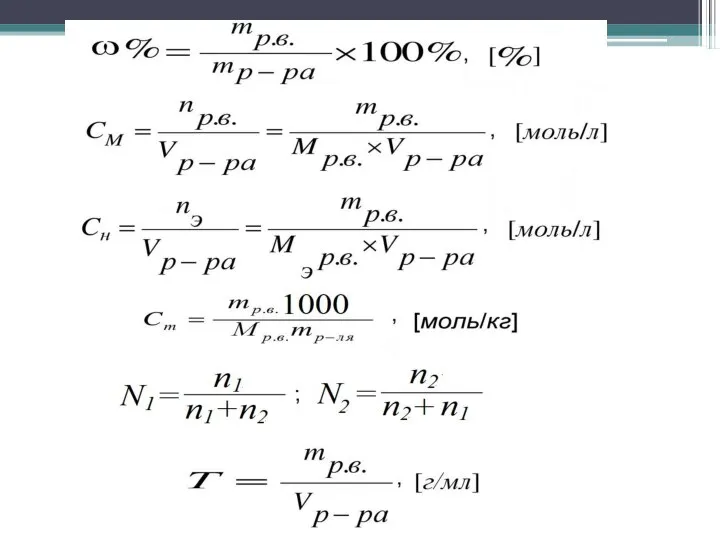
- 12. Способы выражения концентраций растворов 1. Процентная концентрация по массе – число единиц массы (например, числом граммов)
- 13. 4. Мольно-массовая концентрация или моляльность – число молей растворенного вещества, приходящихся на 1000 г растворителя. Обозначается
- 15. Пользуясь растворами, концентрация которых выражена нормальностью, легко заранее рассчитать, в каких объемных отношениях они должны быть
- 16. Свойства растворов По способности проводить электрический ток все растворы делятся на: Растворы электролитов - вещества, растворы
- 17. Растворы неэлектролитов У идеальных растворов (как и у идеальных газов) некоторые свойства не зависят от природы
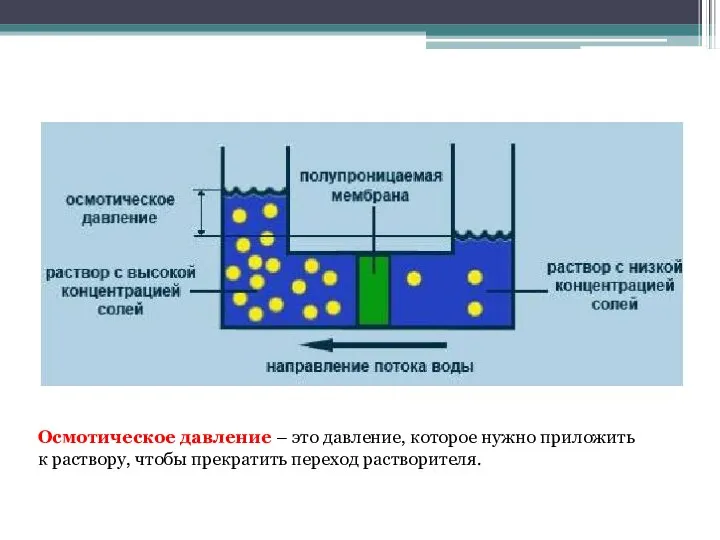
- 18. Осмотическое давление – это давление, которое нужно приложить к раствору, чтобы прекратить переход растворителя.
- 19. При измерениях осмотического давления различных растворов было установлено, что величина осмотического давления зависит от концентрации раствора
- 20. Осмотическое давление растворов электролитов выше осмотического давления растворов неэлектролитов той же молярной концентрации. Это связано с
- 21. Изотонический коэффициент связан со степенью диссоциации электролита (α) соотношением: α = (i-1) / (k-1), где k
- 22. Еще одним из важнейших коллигативных свойств идеальных растворов является давление насыщенного пара растворителя над раствором. Вследствие
- 23. Эбулиоскопия. Криоскопия Давление насыщенного пара над раствором ниже, чем над чистым растворителем, а т.к. давление насыщенного
- 24. Рауль установил, что для разбавленных растворов неэлектролитов повышение температуры кипения и понижение температуры замерзания пропорциональны концентрации
- 25. Учет того факта, что число частиц в растворе за счет электролитической диссоциации может быть больше, чем
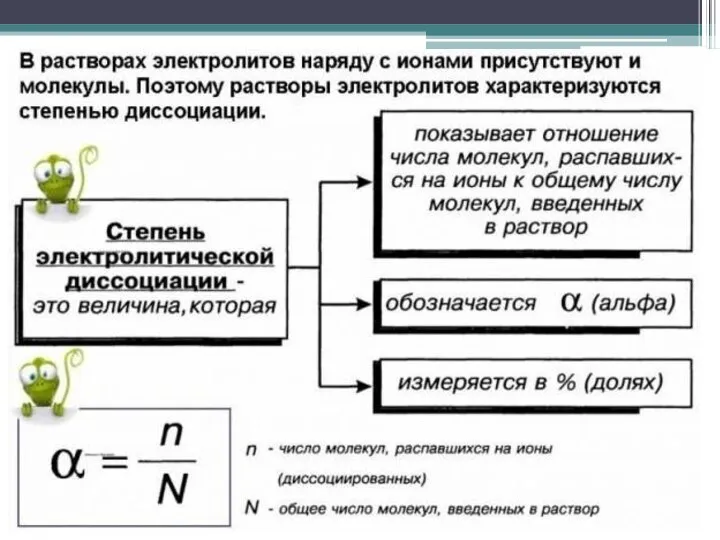
- 26. Растворы электролитов В природе очень распространенным является случай, когда в результате действия растворителя молекулы растворяемого вещества
- 28. Степень диссоциации зависит от природы электролита, его концентрации, природы растворителя, присутствия в растворе одноименных ионов, температуры.
- 29. К сильным электролитам относятся такие, которые в 0,1 М растворе имеют α>30%. Сильными электролитами являются: 1)
- 30. Диссоциация оснований Согласно теории электролитической диссоциации, основания – это электролиты, которые при диссоциации образуют только один
- 31. Диссоциация амфотерных гидроксидов Амфотерные гидроксиды диссоциируют в водном растворе как по типу кислоты, так и по
- 32. 2. Кислые соли при растворении в воде образуют катион металла и сложный анион из атомов водорода
- 33. 4. В результате диссоциации водный раствор двойной соли содержит два катиона и анион кислотного остатка: KAl(SO4)2
- 34. Константа диссоциации К равновесию, которое устанавливается в растворе слабого электролита между молекулами и ионами, можно применить
- 35. Активность ионов. Ионная сила раствора Для оценки состояния ионов в растворе пользуются активностью – условной (эффективной)
- 37. Скачать презентацию







![Отсюда вытекают условия образования и растворения осадка: 1) если [An+]m·[Bm-]n = ПРAmBn,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/998737/slide-9.jpg)






















 Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Презентация на тему Химия и сельское хозяйство Пестициды
Презентация на тему Химия и сельское хозяйство Пестициды  Почему химия важна в профессии ювелира?
Почему химия важна в профессии ювелира? Строение и свойства металлов
Строение и свойства металлов Оксиды. Физические свойства
Оксиды. Физические свойства Предмет органической химии
Предмет органической химии Азотосодержащие соединения: Амины. Аминокислоты. Белки
Азотосодержащие соединения: Амины. Аминокислоты. Белки Химия и производство. Химическая промышленность
Химия и производство. Химическая промышленность Химия в моей специальности
Химия в моей специальности Аварийно-химически опасное вещество (АХОВ)
Аварийно-химически опасное вещество (АХОВ) Химические соединения в живых организмах. Неорганические вещества
Химические соединения в живых организмах. Неорганические вещества Химическая посуда и лабораторное оборудование
Химическая посуда и лабораторное оборудование Классы неорганических соединений
Классы неорганических соединений Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М
Химия. Зачем она нужна? Дистанционный конкурс «Химия без лаборатории» Ученица 10 класса Климашина Василиса, ГОУСОШ № 464 – ЦАО, г. М Скорость химических реакций. Химическое равновесие
Скорость химических реакций. Химическое равновесие Презентация на тему Стекло
Презентация на тему Стекло  ОГЭ №1, вопрос 1-16
ОГЭ №1, вопрос 1-16 Презентация на тему Способы получения металлов
Презентация на тему Способы получения металлов  Fyzikálne a chemické deje
Fyzikálne a chemické deje Презентация на тему Химический состав клетки: ультрамикроэлементы
Презентация на тему Химический состав клетки: ультрамикроэлементы  Присадки для базовых масел. Присадки и наполнители пластичных смазок
Присадки для базовых масел. Присадки и наполнители пластичных смазок Калий. В природе
Калий. В природе Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях
Сравнительный анализ Фармакопейных статей для субстанций, представленных в мировых Фармакопеях Опыты с водой
Опыты с водой Планирование экспериментов предметной области кандидатской диссертации
Планирование экспериментов предметной области кандидатской диссертации Фотометрический анализ
Фотометрический анализ Типы кристаллических решеток
Типы кристаллических решеток Chem-квест. Химический диктант
Chem-квест. Химический диктант