Слайд 2Давайте, вспомним!!!
Признаки химической реакции!

Слайд 3Признаки химических реакций.
Выделение газа.
Образование воды.
Выпадение осадка.
Изменение цвета раствора.
Растворение осадка.

Слайд 5Цель: изучить свойства кислот, оснований и солей как электролитов.
Оборудование: пробирки, штатив.
Реактивы: разбавленная

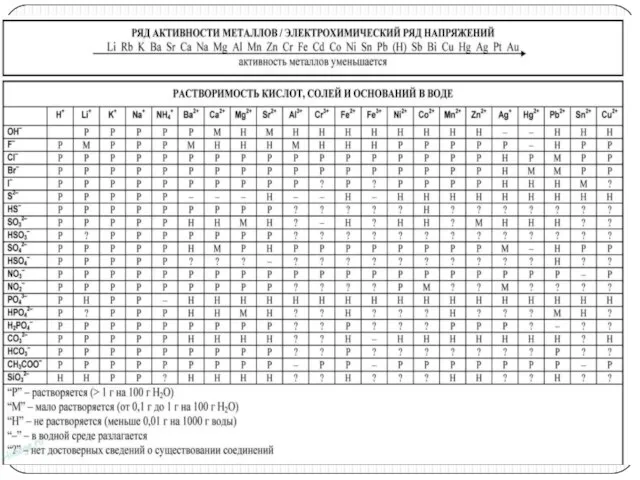
H2SO4, HCl, стружки Mg, кусочек Zn, MgCl2, NaOH, Na2CO3, Zn(NO3)2, K3PO4, KNO3, Na2S, K2CO3, ZnCl2, HNO3, Na2SO3, CuSO4,FeCl3, CaCl2, AgNO3.
Слайд 6Ход работы
Задание 1.
Вариант 1. Взаимодействие разбавленной серной кислоты и цинка.
H2SO4 +

Zn = ZnSO4 + H2
2H+ + SO42- + Zn = Zn2+ + SO42- + H2
2H+ + Zn = Zn2+ + H2
Наблюдаем выделение бесцветного газа - H2
Слайд 7Задание 1.
Вариант 2. Взаимодействие соляной кислоты и магния.
(выполняем самостоятельно!)

Слайд 8Задание 2.
Вариант 1. Свойства хлорида магния.
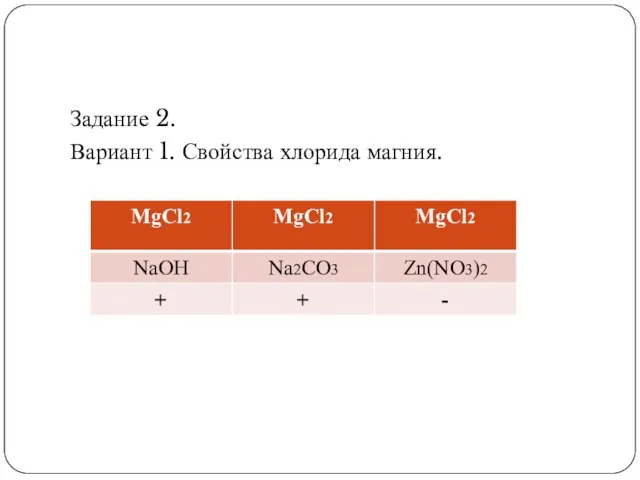
Слайд 9MgCl2 + 2NaOH = Mg (OH)2 + 2NaCl
Mg2+ + 2Cl- + 2Na+

+2OH- = Mg (OH)2 +2Na+ + 2Cl-
Mg2+ + 2OH- = Mg (OH)2
Наблюдаем выпадение осадка белого цвета!
Слайд 10MgCl2 + Na2CO3 = Mg CO3 + 2NaCl
Mg2+ + 2Cl- + 2Na+

+CO2- = Mg CO3 +2Na+ + 2Cl-
Mg2+ + CO2- = Mg CO3
Наблюдаем выпадение осадка белого цвета!
Слайд 11MgCl2 + Zn(NO3)2 =
реакция не идет, потому что нет признака реакции!!!

Слайд 12Задание 2.
Вариант 2. Свойства хлорида магния.
(выполняем самостоятельно!)

Слайд 14K2CO3 + 2HCl = 2KCl + H2O + CO2
2K+ + CO32-+2H++2Cl- =

2K+ + 2Cl- + H2O + CO2
CO32-+2H+ = H2O + CO2
Наблюдаем выделение бесцветного газа, без запаха!!!
Слайд 15Na2S + H2SO4 = H2S + Na2SO4
2Na+ + S2- + 2H+ +

SO42- = H2S + 2Na+ + SO42-
S2- + 2H+ = H2S
Наблюдаем выделение газа с неприятным запахом тухлых яиц!
Слайд 16ZnCl2 +HNO3 =
Реакция не протекает!!!

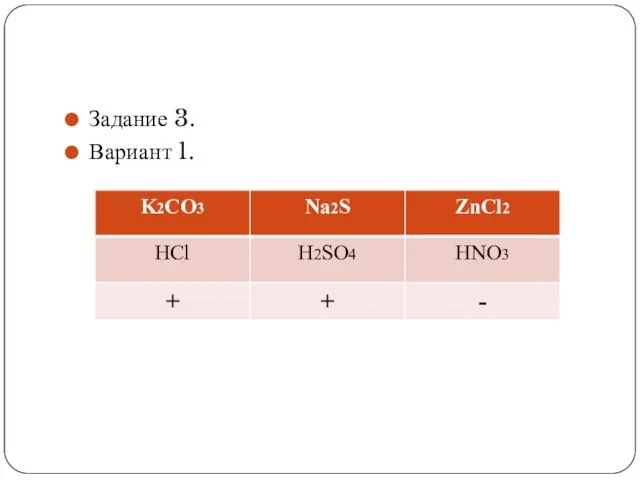
Слайд 17Задание 3.
Вариант 2.
(выполняем самостоятельно!)

Слайд 18Задание 5.
Вариант 1.
a) получение гидроксида железа (III)
FeCl3 + 3NaOH = Fe (OH)3

+ 3NaCl
Fe 3+ + 3Cl- + 3Na+ + 3OH- = Fe (OH)3 + 3Na+ + 3Cl-
Fe 3+ + 3OH- = Fe (OH)3
Наблюдаем выпадение осадка бурого цвета!!!
Слайд 19Задание 5.
Вариант 1.
б) получение сульфида меди (II)
Na2S + CuSO4 = CuS +

Na2SO4
2Na+ + S2- + Cu2+ + SO42- = CuS + 2Na+ + SO42-
S2- + Cu2+ = CuS
Наблюдаем выпадение осадка черного цвета!!!
Слайд 20Задание 5.
Вариант 2.
(выполняем самостоятельно!)


















 Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"
Презентация по Химии "Группа веществ, изолируемых из биологического материала экстракцией и сорбцией"  Презентация
Презентация Структура периодической таблицы элементов
Структура периодической таблицы элементов Химический анализ
Химический анализ Взаимное притяжение и отталкивание молекул
Взаимное притяжение и отталкивание молекул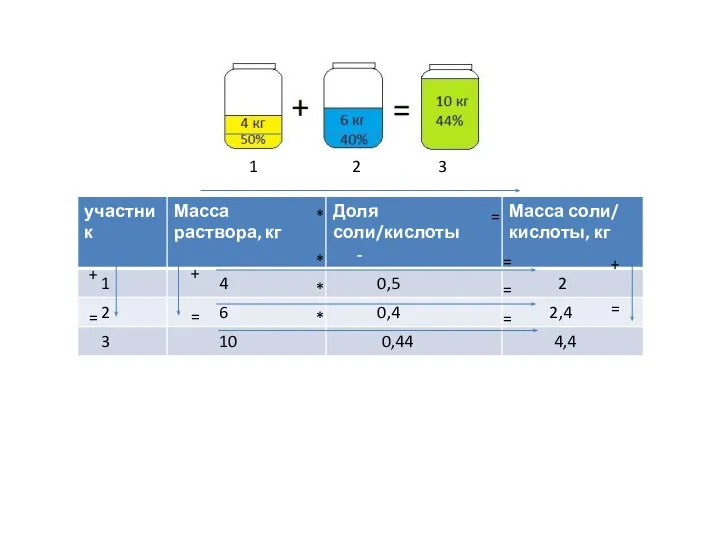 Концентрация растворов
Концентрация растворов Скорость химических реакций
Скорость химических реакций Алкины
Алкины Химическая связь
Химическая связь Оксосоединения. Альдегиды и кетоны
Оксосоединения. Альдегиды и кетоны Окислительно-восстновительные реакции
Окислительно-восстновительные реакции Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона
Мои НИОКР металлорганической химии против рака, Альцгеймера и Паркинсона Неметаллы. 8 класс
Неметаллы. 8 класс Сұрақтар
Сұрақтар Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Строение атома. Планетарная модель атома Резерфорда
Строение атома. Планетарная модель атома Резерфорда Биогаз. Технология производства
Биогаз. Технология производства Химические свойства кислот
Химические свойства кислот Циклоалканы. Строение молекул
Циклоалканы. Строение молекул Соли. Состав и классификация
Соли. Состав и классификация Массообменные процессы
Массообменные процессы Электронное и пространственное строение алкенов. Гомология и изомерия алкенов
Электронное и пространственное строение алкенов. Гомология и изомерия алкенов Строение и свойства этилена
Строение и свойства этилена Классы неорганических соединений
Классы неорганических соединений Аминокислоты. Классификация, номенклатура
Аминокислоты. Классификация, номенклатура ЛБ 1 ОВР (1)
ЛБ 1 ОВР (1) Циклоалканы
Циклоалканы Вырсова И.Е.
Вырсова И.Е.