Слайд 2Тривиальные названия веществ (купоросное масло — серная кислота,
негашеная известь- оксид

кальция)
Рациональная номенклатура для неорганический веществ
СО2 — оксид углерода (IV), тривиальное название «углекислый газ»;
Международная номенклатура
Построение названий органических веществ в соответствии с номенклатурой IUPAC
Слайд 3 Основоположником химической «письменности» считают шведского ученого
Й. Я. Берцелиус, который предложил

в качестве символов («букв») химических элементов использовать начальные буквы их латинских названий, а если с этой буквы начинаются названия нескольких элементов, то добавлять к начальной букве еще одну из последующих букв названия
Слайд 5Этимология названий химических элементов
Свойства простых веществ, образованных химическими элементами (водород — «рождающий

воду», кислород — «рождающий кислоты»).
Мифы древних греков. Например, тантал и прометий.
Географические начала — названия: государств (галлий, германий, полоний, рутений); частей света (америций, европий); городов (гафний — в честь Копенгагена, лютеций — в честь Парижа).
Астрономические начала: селен — в честь Луны (Селены), уран, нептуний, плутоний.
Имена великих ученых: кюрий, эйнштейний , менделевий.
Слайд 6Классификация неорганических веществ
и принципы образования их названий

Слайд 7
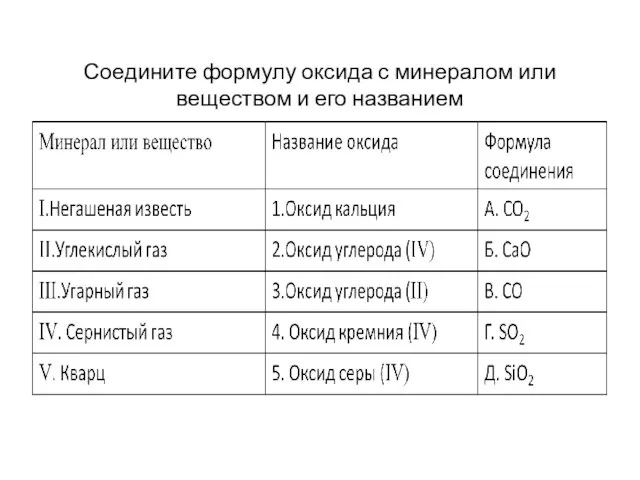
Соедините формулу оксида с минералом или веществом и его названием
Слайд 9ОСНОВАНИЯ.
общая формула оснований: Mn+(OH)n, где n — заряд иона = с. о.

Слайд 10Классификация оснований
1. По растворимости:
Растворимые
Нерастворимые
2. По числу (ОН)- групп
Однокислотные MOH NaOH
Двухкислотные M(OH)2

Ca(OH)2
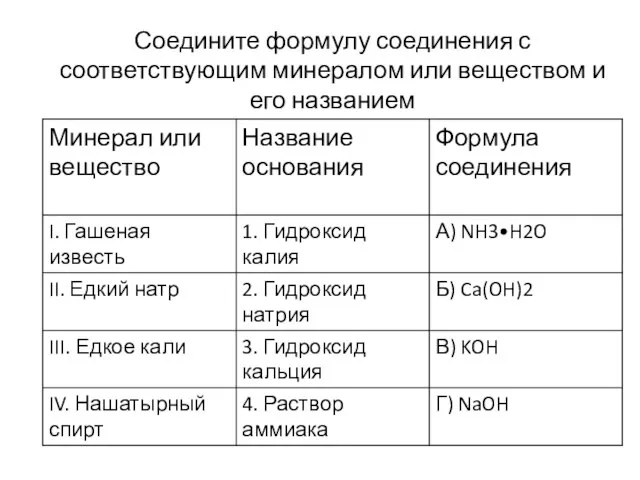
Слайд 12Соедините формулу соединения с соответствующим минералом или веществом и его названием
Слайд 13Кислоты
Кислоты – это сложные вещества, состоящие из атомов водорода и кислотного

остатка.
В растворе образуют простые ионы водорода Н+ и сложные или простые ионы кислотного остатка
Общая формула кислот НnAcdn- , где n- заряд кислотного остатка
Слайд 14Классификация кислот
По содержанию атомов кислорода
бескислородные (H2S);
кислородсодержащие (HNO3, H2SO4).
По количеству кислых атомов водорода:
одноосновные (HNO3);
двухосновные (H2SO4);
трёхосновные (H3PO4)
По растворимости

в воде
Растворимые (H2SO4);
Нерастворимые (H2SiO3);
По устойчивости
Устойчивые (H2SO4);
Неустойчивые (H2CO3).
Слайд 15Соли
Сложные вещества;
Состоят из положительных ионов металла и отрицательных ионов кислотного остатка
Способ образование

названий солей
Название иона кислотного остатка + название металла (М) + (с. о. M, если она переменная)














 Презентация на тему Производство аммиака
Презентация на тему Производство аммиака  Диаграммы состояния сплавов двухкомпонентных систем
Диаграммы состояния сплавов двухкомпонентных систем Парфюмерные товары
Парфюмерные товары Комплексные соединения
Комплексные соединения Hydroxidy. Vlastnosti
Hydroxidy. Vlastnosti Презентация на тему Экологические риски при добыче и переработке нефти
Презентация на тему Экологические риски при добыче и переработке нефти  Презентация на тему Хлор
Презентация на тему Хлор  Супер-химия. Викторина
Супер-химия. Викторина Производство полимеров в РК
Производство полимеров в РК Способы разделения нефти. Ректификация
Способы разделения нефти. Ректификация Алкены (непредельные углеводороды)
Алкены (непредельные углеводороды) Презентация на тему Техника безопасности для учащихся в кабинете химии
Презентация на тему Техника безопасности для учащихся в кабинете химии  Алканы
Алканы Общие способы получения металлов
Общие способы получения металлов Свойства кремниевой кислоты и области применения силикатов
Свойства кремниевой кислоты и области применения силикатов Щелочноземельные металлы
Щелочноземельные металлы Презентация по Химии "Ароматические углеводороды в природе. Области их применения"
Презентация по Химии "Ароматические углеводороды в природе. Области их применения"  Презентация на тему Основные химические понятия
Презентация на тему Основные химические понятия  Коррозия металлов и ГЭ
Коррозия металлов и ГЭ Презентация на тему Теория строения органических соединений
Презентация на тему Теория строения органических соединений  Тест. Химическая связь
Тест. Химическая связь Степень диссоциации. 9 класс
Степень диссоциации. 9 класс Основы МКТ
Основы МКТ Неорганические вещества в быту
Неорганические вещества в быту Пероксид водорода
Пероксид водорода Алюминий и его соединения
Алюминий и его соединения Знакомый и незнакомый углерод (9 класс)
Знакомый и незнакомый углерод (9 класс) Химико-металлургические методы
Химико-металлургические методы