Содержание
- 2. Уран и торий – наиболее распространенные члены семейства актинидов, в которое входят также актиний, протактиний и
- 3. Торий Торий (Th) радиоактивный химический элемент, открыт в 1828 году И.Я. Берцелиусом. Назван в честь скандинавского
- 4. Торий По химическим свойствам он близок к РЗЭ, особенно к Се. Оба проявляют наиболее устойчивую в
- 5. Торий В химии известны различные состояния окисления Th; наиболее устойчив Th4+: ([Rn])ThO2, [Th(H2O)]4+(aq), ThF4, ThCl4) и
- 6. Уран Открыт в 1789 году, но в чистом виде (металл серо-стального цвета) выделен только в 1841
- 7. Кислотно-щелочные свойства
- 8. Уран Химически U весьма активен, имеет переменную валентность - 3+, 4+, 5+, 6+; особенно устойчивое состояние
- 9. Потенциал восстановления
- 10. Уран (IV) в своих соединениях присутствует в форме иона U4+. По химическим свойствам он близок к
- 11. Ионные радиусы
- 12. Уран (VI) — наиболее устойчивая степень окисления урана при свободном доступе воздуха. Валентность 6 является высокой
- 13. Уранил-ион По размерам уранил-ион превышает все известные в природе катионы и равен 6,04- 6,84 Å. В
- 14. Соединения U(VI) сравнительно хорошо растворимы и устойчивы в водных растворах. Наиболее растворимы уранил-нитраты. Хорошо растворимы сульфаты
- 15. Наиболее важное значение в природных условиях имеют карбонатные, сульфатные, фторидные, фосфатные и гидроксильные комплексы. Аквагидроксокомплексы уранила
- 16. Ионы U6+ наиболее устойчивы в условиях окислительной обстановки и отличаются от U4+более высоким значением ионной плотности;
- 17. Характерна тенденция U6+ к образованию комплексов с карбонатными, сульфатными, фторидными, фосфатными ионами (но не Сl, Br
- 18. Радий (Ra) Известны 4 природных изотопа радия: 223Ra (T1/2=11,2 дня), 224Ra (T1/2=3,6 дня), 226Ra (T1/2=1602 года),
- 19. Радон (Rn) В природе известно 3 изотопа радона: 222Rn (радон, T1/2=3,8 дня), 220Rn (торон, T1/2=54,5 с.),
- 20. Изотопы радона растворимы в воде и других жидкостях. Коэффициент растворимости в воде при 15 0С варьирует
- 21. Полоний (Po) В природе известен ряд изотопов полония: 210Po (T1/2=138 дней), 214Po (T1/2=1,6·10-4 с), 218Po (T1/2=3,5
- 22. В природные растворы Ро поступает в ультрамикроконцентрациях. Он склонен к образованию псевдоколлоидов, которые возникают в. результате,
- 23. Протактиний (Pa) Атом Pa (5f56d17s2) состоит только из радиоактивных изотопов. В природе установлено лишь два изотопа:
- 24. Протактиний (Pa) Катионы протактиния легко образуют комплексные соединения, однако большинство из них так же неустойчиво к
- 25. Гелий (He) Гелий – нерадиоактивный элемент. После водорода гелий – самый легкий из всех газов. Относится
- 26. Ряды распада В отличие от долгоживущих природных радионуклидов 238U, 235U и 232Th не сразу превращаются в
- 27. Ряды распада Конечными стабильными продуктами всех трех рядов являются изотопы свинца: 206РЬ, 207РЬ, 208РЬ, которые носят
- 28. Ряды распада
- 29. Альфа-распад заключается в способности ядер превращаться в другие более легкие ядра путем испускания α-частиц – ядер
- 31. В каждом из природных рядов встречается определенная последовательность превращений, когда за одним альфа-распадом следуют два бета-распада
- 32. Радиоактивное равновесие в рядах распада Члены каждого ряда связаны друг с другом последовательными необратимыми альфа- и
- 33. Это соотношение определяет так называемое «вековое» равновесие (Баранов, 1956). Скорость установления радиоактивного равновесия в ряду распада
- 34. В зависимости от соотношения периодов полураспада материнского ТМ и дочернего TД может встречаться несколько вариантов изменения
- 35. Радиоактивное равновесие в данном ряду распада считается нарушенным, если соотношение между членами ряда не удовлетворяет приведенному
- 36. Существуют три основные группы факторов, приводящие к нарушению радиоактивного равновесия в рядах распада (Титаева,2005): – различие
- 37. Рассмотрим некоторые примеры (Титаева, 2000). 1) При выветривании горных пород природные воды будут окислять атомы урана,
- 39. Скачать презентацию
Слайд 2Уран и торий – наиболее распространенные члены семейства актинидов, в которое входят
Уран и торий – наиболее распространенные члены семейства актинидов, в которое входят
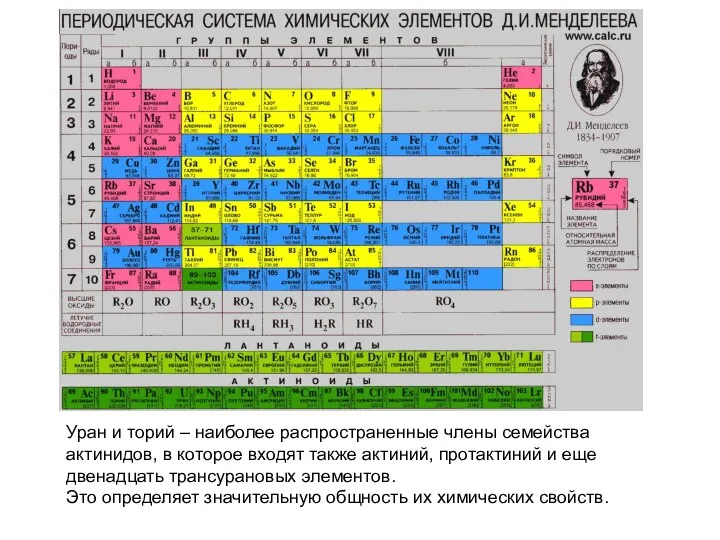
Это определяет значительную общность их химических свойств.
Слайд 3Торий
Торий (Th) радиоактивный химический элемент, открыт в 1828 году И.Я. Берцелиусом. Назван
Торий
Торий (Th) радиоактивный химический элемент, открыт в 1828 году И.Я. Берцелиусом. Назван

Атом тория представлен радиоактивными природными изотопами: 232Th (~ 100 %, (Т1/2 - 1,4·1010 лет); 228Th (радиоторий X и UX1', Т1/2 - 1,9 лет); 230Th (ионий Io, Т1/2 - 8·104 лет), 234Th (уран X1 - UX, T1/2 - 24,1 дня); 227Th (радиоактивный X - UX; Т1/2 - 18,7 дня); 231Th (уран Y - UY, Т1/2 - 25,5 ч). Известно несколько искусственных короткоживущих (секунды, минуты) изотопов Th. 232Th является вторым по распространенности природным радиоактивным изотопом в земной коре (1,2*10-3 %), уступает только 87Rb (4,16*10-3 %, Т1/2 - 4,9·1010 лет).
Торий (5f6d27s2) радиоактивный fd -металл из группы Ас, в периодической системе расположен в 7-м периоде в III группе вместе с Ti, Zr, Hf и лантаноидами. При совместном рассмотрении с лантаноидами является гомологом Се, по диагонали соседствует с La, Gd, Lu, по горизонтали - с Ac, Ra, и Pa, U. Ко всем этим металлам он более или менее близок по химическим свойствам. По термическим свойствам ближе всего к Y и Lu, по энергии образования изолированных атомов - к Zr, Hf, U. Сочетание высокой температуры плавления - Th (металл) 1800°С и ThO2 3222°С, близкой к таковой Ti, и большой химической активности (близкой к активности Mg) отличает Th от U и большинства других металлов.
Слайд 4Торий
По химическим свойствам он близок к РЗЭ, особенно к Се. Оба проявляют
Торий
По химическим свойствам он близок к РЗЭ, особенно к Се. Оба проявляют

Th окисляется на воздухе при температуре 20°C, реагирует с Н2O с образованием защитной пленки ThO2; при низких температурах взаимодействует с F (ThF4), при нагревании (до ~ 45°С) - с CI, Br, I, S, при 600°С - с Н2 (ThH2), при 800°С образует нитриды, фосфиды, карбиды, силициды, а также интерметаллы и сплавы, пока не установленные а природе. Многие соли Th (галогениды, кроме F), сульфаты растворимы в Н2O и разбавленных кислотах. При 20°С хорошо растворим Th(NO3)4 - 190,7 г/100 г, практически не растворим ThF4 - 0,2 г/100 г, a ThCl4 реагирует с Н2O; не растворимы фосфаты, хроматы, молибдаты, оксикарбонат, оксалат, сульфит. Характерно образование многочисленных комплексных соединений Th4+, в том числе растворимых (карбонатные и другие комплексы).
Слайд 5Торий
В химии известны различные состояния окисления Th; наиболее устойчив Th4+: ([Rn])ThO2, [Th(H2O)]4+(aq),
Торий
В химии известны различные состояния окисления Th; наиболее устойчив Th4+: ([Rn])ThO2, [Th(H2O)]4+(aq),
![Торий В химии известны различные состояния окисления Th; наиболее устойчив Th4+: ([Rn])ThO2,](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/979955/slide-4.jpg)
Стандартный потенциал восстановления Е° (В): Th4+ → Th°= - 1,83 (кислый раствор); ThO2 → Th° = - 2,56 (щелочной раствор) и окисления Тh(тв.) → Th(OH)4 (тв.) = - 2,48.
Гидроксид (произведение растворимости 10-39 - 10-42) Th(OH)4 начинает осаждаться из растворов при рН > 3,5; в присутствии карбонатов щелочных металлов и солей органических кислот образует растворимые комплексы (Титаева, 1991). При рН > 3,5 микроконцентрации тория образуют в растворе коллоидный Th(OH)4. Процесс гидролиза Th4+ носит сложный характер, предполагает наличие, кроме Th(OH)4, и других форм Th(OH)3+, Th2(OH)26- и др.
В порошке торий пироморфен, температура воспламенения 270°С, нижний предел взрываемости 75 г/м3.
Слайд 6Уран
Открыт в 1789 году, но в чистом виде (металл серо-стального цвета) выделен
Уран
Открыт в 1789 году, но в чистом виде (металл серо-стального цвета) выделен

Уран (5f36d17s2) является fd-металлом и принадлежит к 3-й группе периодической системы, подгруппе актиноидов: по группе наиболее близок к W, Мо, в какой-то мере к Но, Nd, а по периоду - к Th.
Металлический U, как и Th, взаимодействует с O2 с образованием защитной пленки оксидов, неравновесных при комнатных температурах (t) и давлении (P). Соединения UO часто содержат N и С, a UO2 и UO2+x окисляются при повышенных температурах и давлении до более высоких оксидов вплоть до UО3. Из многочисленных кислородных соединений наиболее устойчивыми считаются UO2 (тип флюорита U16O36+m) и типа уранила [UO2]2+ или U5nО13n+3, которые относятся к двум разным гомологическим рядам оксидов U.
Металлический U имеет сильную восстановительную способность, в порошке пироморфен, сильный комплексообразователь, образует фториды, нитриды, гидриды, сульфиды, а также сплавы с металлами. Характерная особенность химии U - высокая летучесть его карбидов, галоидов, уранилов и др. У всех соединений U преобладают основные свойства. Металлический U реагирует с Н2O при t > 100°С, UH3, UC2 и UC реагируют с холодной и горячей Н2O.
Слайд 7Кислотно-щелочные свойства
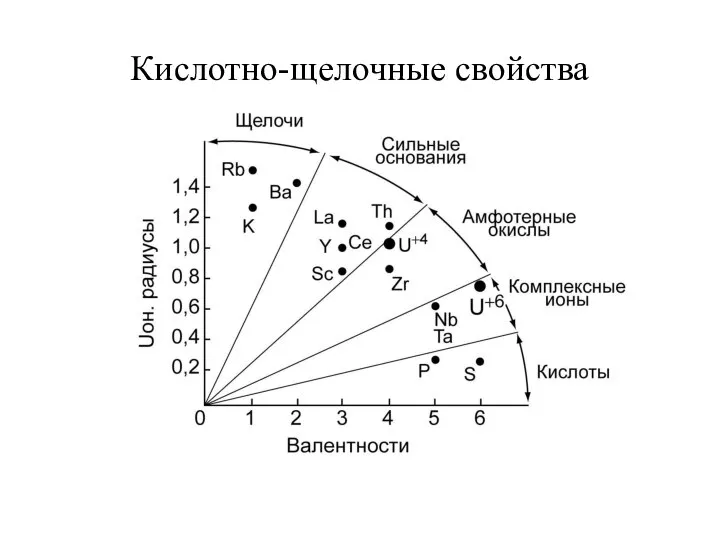
Кислотно-щелочные свойства
Слайд 8Уран
Химически U весьма активен, имеет переменную валентность - 3+, 4+, 5+, 6+;
Уран
Химически U весьма активен, имеет переменную валентность - 3+, 4+, 5+, 6+;

U4+ в природе по свойствам наиболее близок к Th4+, лантаноидам: TR4+ (Сe4+, Pr, Tb), TR3+ (Nd, Ho), и к элементам иттриевой группы. U отличается от всех элементов очень крупным размером комплексного катиона (UO2)2+, способным образовывать собственные урановые минералы. В этом отношении катион U6+ сходен с анионами W6+ (WO42-) и особенно с Мо6+ (МoO42-) устойчивостью анионных комплексов. Менее устойчивы другие состояния окисления U. Стандартные потенциалы восстановления Е° (В)
Слайд 9Потенциал восстановления
Потенциал восстановления

Слайд 10Уран (IV) в своих соединениях присутствует в форме иона U4+. По химическим
Уран (IV) в своих соединениях присутствует в форме иона U4+. По химическим

Отличительной особенностью, отличающей геохимию U4+ от лантаноидов, Ti2+ и других элементов-гидролизатов является высокая среди катионов степень подвижности в водных растворах.
Слайд 11Ионные радиусы
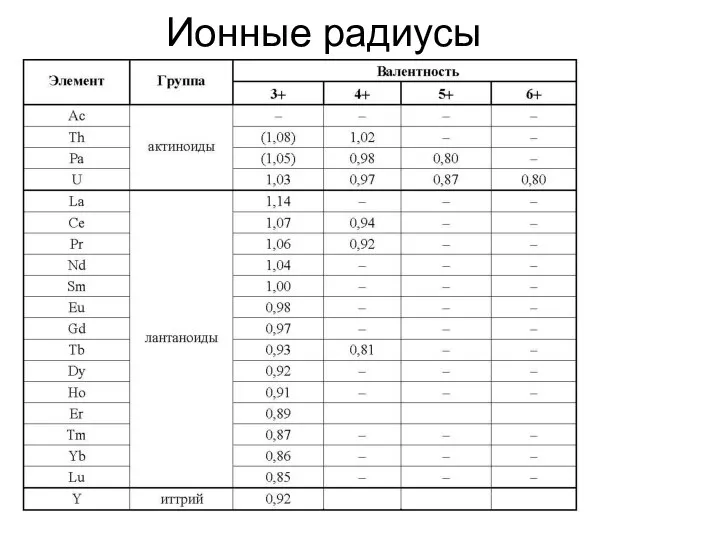
Ионные радиусы
Слайд 12Уран (VI) — наиболее устойчивая степень окисления урана при свободном доступе воздуха.
Уран (VI) — наиболее устойчивая степень окисления урана при свободном доступе воздуха.

Слайд 13Уранил-ион
По размерам уранил-ион превышает все известные в природе катионы и равен 6,04-
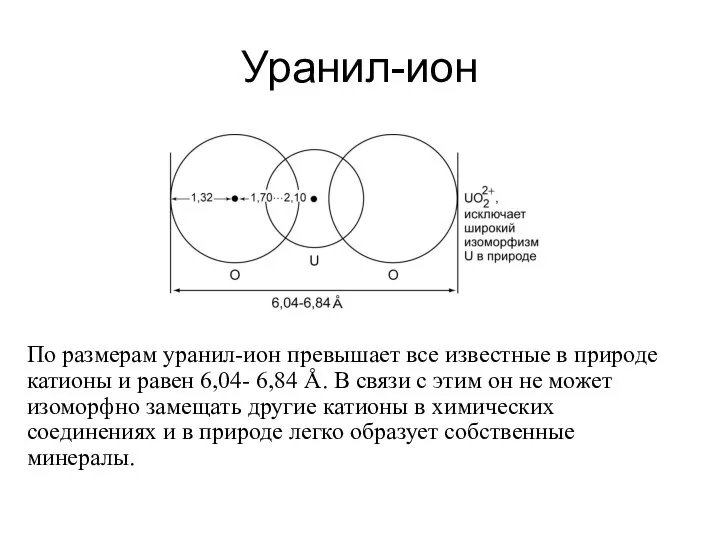
Уранил-ион
По размерам уранил-ион превышает все известные в природе катионы и равен 6,04-
Слайд 14Соединения U(VI) сравнительно хорошо растворимы и устойчивы в водных растворах. Наиболее растворимы
Соединения U(VI) сравнительно хорошо растворимы и устойчивы в водных растворах. Наиболее растворимы

U (VI) проявляет большую склонность к образованию комплексных соединений, которые играют важную роль в его геохимии. Во всех этих соединениях уран находится в форме уранил-иона, который имеет координационные числа 4 и 6. Комплексообразование U (VI) с Сl-, Вr- и NO3- идет слабо.
Слайд 15Наиболее важное значение в природных условиях имеют карбонатные, сульфатные, фторидные, фосфатные и
Наиболее важное значение в природных условиях имеют карбонатные, сульфатные, фторидные, фосфатные и

Аквагидроксокомплексы уранила образуются при ступенчатом замещении аквагрупп в акваионе уранила [UO2(H2O)6]2+ и имеют форму [UO2(OH)n(H2O)6-n]2-n (n - от 0 до 6) (Наумов, 1978).
Карбонатные комплексы образуют семейство соединений, среди которых в водных растворах устойчивы лишь [UO2(CO3)3]4- и [UO2(CO3)2(H2O)2]2-. Первый преобладает в растворе с избытком ионов СO32- и при разбавлении переходит во второй. Следующей ступенью является образование слаборастворимого карбоната уранила UO2CO3.
Фторидные комплексы образуются лишь в средах с высокими концентрациями фтора.
Сульфатные комплексные соединения уранила по строению подобны карбонатным, однако по прочности уступают не только карбонатным, но и фторидным. Они характерны лишь для кислой среды с рН 2—4.
Очень важную группу комплексных соединений уранил-ион образует с органическими кислотами (щавелевой, уксусной, лимонной, группой гумусовых кислот и т. д.).
Слайд 16Ионы U6+ наиболее устойчивы в условиях окислительной обстановки и отличаются от U4+более
Ионы U6+ наиболее устойчивы в условиях окислительной обстановки и отличаются от U4+более

Важное химическое свойство U (особенно U6+) - его сильная восстановительная способность, например для Fe3+. Соединения U6+, растворимы в Н2O, особенно уранил-нитраты, а также сульфаты и оксигалогениды (UO2C12 и UO2F2); UF6 и UC16 летучи, но легко гидролизуются, образуя оксигалогениды.
UO4·2H2O растворим в холодной (0,0006 г/100г) и горячей (0,008 г/100г) Н2O; UF4 (0,01 г/100г при 20°С), UF6, UC14 и UC15 гигроскопичны и также реагируют с Н2O при 20°С; хорошо растворим сульфат UO2SO4·3H2O (151,4 г/100г при 20° и 237,8 при 100°С) и UO2F2 (64,4 г/100г при 20° и 74 при 100°С). Главные нерастворимые соединения U6+ - оксиды, фосфаты, арсенаты и ванадаты, которые известны в качестве экзогенных урановых минералов.
Слайд 17Характерна тенденция U6+ к образованию комплексов с карбонатными, сульфатными, фторидными, фосфатными ионами
Характерна тенденция U6+ к образованию комплексов с карбонатными, сульфатными, фторидными, фосфатными ионами

Слайд 18Радий (Ra)
Известны 4 природных изотопа радия: 223Ra (T1/2=11,2 дня), 224Ra (T1/2=3,6 дня),
Радий (Ra)
Известны 4 природных изотопа радия: 223Ra (T1/2=11,2 дня), 224Ra (T1/2=3,6 дня),

Слайд 19Радон (Rn)
В природе известно 3 изотопа радона: 222Rn (радон, T1/2=3,8 дня), 220Rn
Радон (Rn)
В природе известно 3 изотопа радона: 222Rn (радон, T1/2=3,8 дня), 220Rn

Химические свойства радона определяются его положением в группе благородных газов Периодической системы. В соответствии с этим, для него характерна химическая инертность и валентность, равная 0. Он не вступает в реакцию с кислородом даже в искровом разряде и в присутствии катализаторов. В обычных условиях радон находится в молекулярном состоянии в виде Rn. Однако он может образовывать клатратные соединения с водой, фенолом, толуолом.
При взаимодействии с газообразным фтором радон способен давать соединения типа RnF4, сокристаллизуясь при этом с ксеноном. Аналогично криптону и ксенону радон образует гексагидраты. Rn·6H2O изоморфен с H2S·6H2O и SO2·6H2O.
Слайд 20Изотопы радона растворимы в воде и других жидкостях. Коэффициент растворимости в воде
Изотопы радона растворимы в воде и других жидкостях. Коэффициент растворимости в воде

Существенно выше его растворимость в органических жидкостях. Хорошая растворимость его в жирах обуславливает его концентрирование жировыми тканями. Радон сорбируется на поверхности твердых тел. Различного рода неогранические гели и органические коллоиды весьма прочно удерживают адсорбированный радон. Лучшим сорбентом является активированный уголь. Адсорбированный радон очень подвижен и легко перераспределяется в твердом теле от крайних молекулярных слоев в более глубокие зоны. Десорбция радона происходит при нагревании. С активированного угля он полностью десорбируется при 350-400 0С.
Выделения радона из одной фазы в другую называют эманированием. Коэффициент эманирования радона kRn равен отношению количеству радона, выделившегося из твердого или жидкого тела к его количеству, образовавшемуся в этом теле за тот же интервал времени. Он варьирует от доли процента до десятков процентов.
Слайд 21Полоний (Po)
В природе известен ряд изотопов полония: 210Po (T1/2=138 дней), 214Po (T1/2=1,6·10-4
Полоний (Po)
В природе известен ряд изотопов полония: 210Po (T1/2=138 дней), 214Po (T1/2=1,6·10-4

Химические свойства полония определяются его положением в VIA группе Периодической системы. Он обладает конфигурацией электронных оболочек подобной селену и теллуру и по химическим свойствам близок к ним. В соответствии с принадлежностью к VIA группе он имеет несколько степеней окисления: -2, +2, +3, +4 и +6. Ро3+ имеет сходство с Bi. Наиболее устойчив в растворе Ро4+.
Слайд 22В природные растворы Ро поступает в ультрамикроконцентрациях. Он склонен к образованию псевдоколлоидов,
В природные растворы Ро поступает в ультрамикроконцентрациях. Он склонен к образованию псевдоколлоидов,

Для Ро характерна способность к комплексообразованию с различными анионами. Геохимическое значение имеет лишь наиболее долгоживущий изотоп - 210Ро. Он образуется при распаде 222Rn. Обычным его спутником является более долгоживущий 210 РЬ (22 года), из которого 210Ро образуется по следующей цепочке:
210РЬ β → 210Bi β → 210Ро α→ 206РЬ.
22 года 5 дней 138 дней
Слайд 23Протактиний (Pa)
Атом Pa (5f56d17s2) состоит только из радиоактивных изотопов. В природе установлено
Протактиний (Pa)
Атом Pa (5f56d17s2) состоит только из радиоактивных изотопов. В природе установлено

Расположен в V группе периодической системы с Та, Pr, Dy и др. и геохимически близок к этим элементам, являясь химическим аналогом тантала. По некоторым свойствам близок также к Zr и Hf.
Протактиний – член семейства актиноидов и, соответственно, по химическим свойствам близок к U и Th. Как и U, взаимодействует с кислотами и водяным паром и не реагирует со щелочами. Относится к химически инертным элементам (как и Та), но на воздухе Ра4+ окисляется в Ра5+ с образованием защитной пленки. Соединения Ра слабо растворимы, легко гидролизуются и быстро адсорбируются коллоидными частицами других веществ, образуя псевдоколлоиды на поверхности твердых фаз. Наиболее типичные простые соединения разной валентности: Ра4+ - PaO2, [Pa(H2O)]4+(aq), PaF4, РаС14 и т.д.; Pa5+ - Pa2O5, РаО2+ (соединения), PaF5 РаСl5 и т.д, [PaF6]-, [PaF,]3-; Ра3+ - PaJ3.
Слайд 24Протактиний (Pa)
Катионы протактиния легко образуют комплексные соединения, однако большинство из них так
Протактиний (Pa)
Катионы протактиния легко образуют комплексные соединения, однако большинство из них так

Металлический Ра при повышенной температуре образует гидрид (250 °С), карбид (1200 °С), оксид Ра2О5 (> 650 °С); известны соединения РаР, РаР2, Ра3Р4 и сходные с As, Sb, S, Se, а также комплексы с NО3, S04, C2H2, CH3 и т.д.
Слайд 25Гелий (He)
Гелий – нерадиоактивный элемент. После водорода гелий – самый легкий из
Гелий (He)
Гелий – нерадиоактивный элемент. После водорода гелий – самый легкий из

В природе известно 2 изотопа гелия – 4He и 3He. 3He рассматривается как газ, захваченный Землей в начальный момент ее формирования, 4He – как продукт термоядерного синтеза и радиоактивного распада тяжелых ядер.
Гелий характеризуется хорошей растворимостью в магматических расплавах. Он способен легко проникать через кварцевое стекло. Это свойство используется в методике его определения. Изотоп 3He – единственное вещество пригодное для измерения температур ниже 1К.
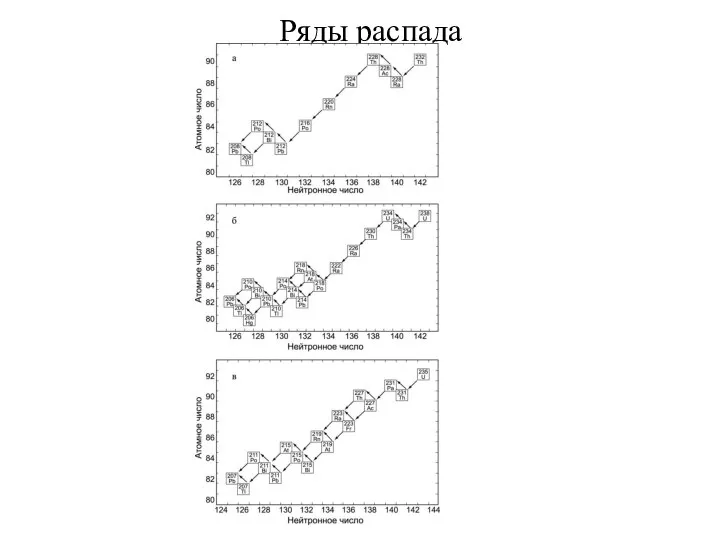
Слайд 26Ряды распада
В отличие от долгоживущих природных радионуклидов 238U, 235U и 232Th не
Ряды распада
В отличие от долгоживущих природных радионуклидов 238U, 235U и 232Th не

Слайд 27Ряды распада
Конечными стабильными продуктами всех трех рядов являются изотопы свинца: 206РЬ, 207РЬ,
Ряды распада
Конечными стабильными продуктами всех трех рядов являются изотопы свинца: 206РЬ, 207РЬ,

Слайд 28Ряды распада
Ряды распада
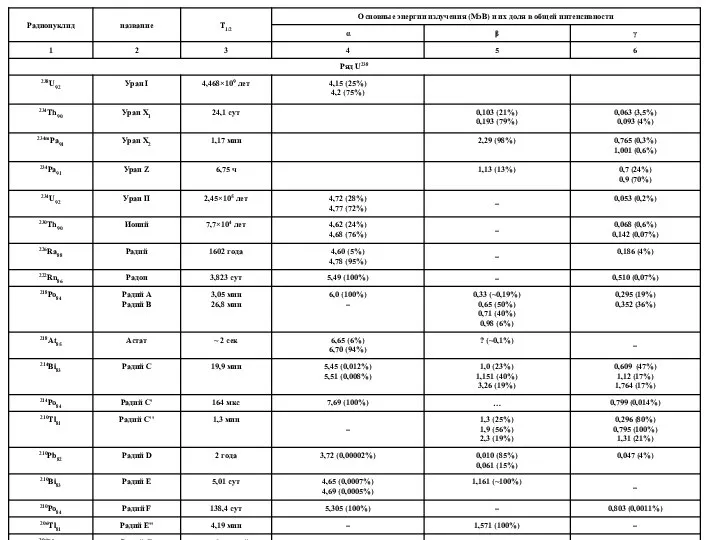
Слайд 29Альфа-распад заключается в способности ядер превращаться в другие более легкие ядра путем
Альфа-распад заключается в способности ядер превращаться в другие более легкие ядра путем

Бета–распад – это переход радиоактивных ядер в стабильное состояние путем превращения избыточных нейтронов в протон с испусканием электрона. При этом формируется β-излучение, представляющее собой поток электронов, образующий в процессе β – распада.
Помимо α-распада для очень тяжелых ядер возможен и иной тип превращений – спонтанное деление на два сравнимых по массе осколка с испусканием нескольких нейтронов. Спонтанное деление наблюдается для ядер с массовым числом не менее 232 и имеет очень малую вероятность по сравнению с конкурирующим α-распадом. Это свойство тяжелых атомов используется в практике для изучения радионуклидов методом осколочной радиографии.
Гамма – излучение представляет собой коротковолновое электромагнитное излучение, возникающее при ядерных превращениях, изменении энергетического состояния ядер и аннигиляции частиц. Длина волны λ для γ-излучения меньше межатомного расстояния (10-10 м). Радионуклиды характеризуются строго определенными спектрами γ-излучения, которые используются для гамма-спектрометрического анализа.
Слайд 31В каждом из природных рядов встречается определенная последовательность превращений, когда за одним
В каждом из природных рядов встречается определенная последовательность превращений, когда за одним

Альфа-распад уменьшает заряд ядра на 2 единицы, а два бета-распада увеличивают его также на 2 единицы, то есть возвращают к прежнему значению. В результате появляется новый изотоп одного и того же элемента, который на 4 атомных единицы массы меньше первичного (за счет альфа-распада). Примером могут служить группы изотопов в ряду урана-238: 238U и 234U, 234Th и 230Th, 218Pb, 214Pb, 210Pb и 206РЬ и др. Аналогичные группы имеют место и в других рядах. Альфа- частицы являются ядрами 4Не. Поэтому при их стабилизации после присоединения двух электронов появляются атомы 4Не. В ряду урана-238 образуется 8 атомов 4Не, в ряду урана-235 - 7 атомов, а в ряду тория-232 - 6 атомов. Таким образом, радиоактивный распад природных рядов ведет к появлению 4Не.
Слайд 32Радиоактивное равновесие в рядах распада
Члены каждого ряда связаны друг с другом последовательными
Радиоактивное равновесие в рядах распада
Члены каждого ряда связаны друг с другом последовательными

N1/T1 = N2/T2 = …Ni/Ti = А или N1/λ1 = N2/ λ2… = Ni/ λi = А;
N1/ λ1/ N2/ λ2 = 1,
где N – число атомов, λ – константа распада, Т – период полураспада, А – активность, Бк.
Слайд 33Это соотношение определяет так называемое «вековое» равновесие (Баранов, 1956). Скорость установления радиоактивного
Это соотношение определяет так называемое «вековое» равновесие (Баранов, 1956). Скорость установления радиоактивного

Слайд 34В зависимости от соотношения периодов полураспада материнского ТМ и дочернего TД может
В зависимости от соотношения периодов полураспада материнского ТМ и дочернего TД может

ТМ < TД. Материнский радионуклид распадается быстрее, чем дочерний. В этом случае равновесие наступить не может, если материнский радионуклид изолирован и не подкреплен предыдущим, более долгоживущим членом ряда. Активность материнского радионуклида при этом уменьшается в соответствии с уравнением
N = N0exp(-At). Примером может служить пара 234Тh (24 дня) - 234U (244 тыс. лет).
2. ТМ > TД. Если период полураспада материнского радионуклида соизмерим или несколько больше периода полураспада дочернего, то с течением времени активность дочернего возрастет до состояния подвижного равновесия с материнским. Затем их активности, равные между собой, будут уменьшаться в соответствии с ТМ. Примером может служить пара 228Ra (5,75 года) – 228Th (1,9 года).
3. TM >> TД. Чаще используются пары, где период полураспада материнского (например, родоначальника ряда) много больше дочернего радионуклида. В этом случае через 10TД (с точностью до 0,1%) наступает вековое равновесие, описываемое приведенным выше уравнением. В природных системах редко встречаются случаи, когда присутствует только материнский радионуклид, а дочерние полностью отсутствуют. Обычно некоторое их количество находится в системе вместе с материнскими атомами.
Слайд 35Радиоактивное равновесие в данном ряду распада считается нарушенным, если соотношение между членами
Радиоактивное равновесие в данном ряду распада считается нарушенным, если соотношение между членами

В открытой системе радиоактивное равновесие может быть нарушено в результате перемещения атомов одних членов ряда относительно других из системы либо в систему. При этом перемещение атомов должно происходить на расстояние, превышающее размер системы, и за время, более короткое, чем то, которое необходимо для восстановления равновесия. Нарушение радиоактивного равновесия является результатом геохимической дифференциации членов одного ряда, где одни из них оказываются в данных условиях более подвижными, чем другие. Важнейшими процессами, приводящими к такой дифференциации, являются процессы растворения и осаждения, которые локализуются на границе раздела жидкой и твердой фаз. Однако подобные процессы нередко могут возникать также и на границах газ/твердое вещество и газ/жидкость.
Слайд 36Существуют три основные группы факторов, приводящие к нарушению радиоактивного равновесия в рядах
Существуют три основные группы факторов, приводящие к нарушению радиоактивного равновесия в рядах

– различие химических свойств элементов, изотопами которых являются исследуемые радионуклиды,
– свойства элементов, связанные с радиоактивностью
– физико-химические условия окружающей среды.
Исключительно химическими свойствами членов рядов распада обусловлено геохимическое поведение лишь наиболее долгоживущих и распространенных в природе родоначальников рядов: 238U и 232Th, концентрации которых сопоставимы с концентрациями большинства микроэлементов. Геохимия остальных членов рядов при равных физико-химических условиях среды обусловлена как их химическими особенностями, так и факторами, связанными с радиоактивностью: а) происхождением из того или иного родоначальника ряда; б) скоростью радиоактивного распада (или накопления); в) энергией радиоактивной отдачи; г) концентрацией и зависимостью от присутствия носителей.
Обычно нарушения радиоактивного равновесия наблюдаются на границе раздела двух фаз, т.е. на границе двух систем. В природе часто такие условия создаются при взаимодействии природных вод, циркулирующих по порам и трещинам, с горными породами, рыхлыми осадками или почвами. В зависимости от состава растворенных в воде ионов, величин рН и Eh одни дочерние нуклиды могут оказаться более растворимы, чем другие. В результате селективного выщелачивания произойдет дифференциация радионуклидов, принадлежащих к одному ряду распада. Жидкая фаза окажется обогащенной наиболее растворимыми членами ряда; твердая фаза, напротив, будет испытывать их дефицит. В результате и горные породы, и циркулирующие по ним воды будут характеризоваться нарушением радиоактивного равновесия в рядах распада. Процессы селективного осаждения радионуклидов из природных вод и последующей их адсорбции на твердой фазе также являются механизмами, способствующими нарушению радиоактивного равновесия среди членов одного ряда.
Слайд 37Рассмотрим некоторые примеры (Титаева, 2000).
1) При выветривании горных пород природные воды будут окислять
Рассмотрим некоторые примеры (Титаева, 2000).
1) При выветривании горных пород природные воды будут окислять

2) В океанической воде 238U и 234U находятся в растворе в составе устойчивых карбонатных комплексов, а образующийся из 234U дочерний радионуклид 230Th будет адсорбироваться на взвешенных частичках или соосаждаться с гидроксидами железа, обогащая таким образом донные осадки. В результате радиоактивное равновесие оказывается нарушенным и в воде, и в осадках.
3) Примером иной геохимической обстановки может служить взаимодействие подземных вод с водовмещающими породами в зоне контакта с углеводородными залежами, создающими резко восстановительные условия. В этих условиях окисления атомов урана не происходит и переход их в воду ничтожно мал. В то же время дочерний 226Ra легко выщелачивается из горных пород и весьма устойчив в растворе в хлоридных бессульфатных барийсодержащих рассолах. В итоге радиоактивное равновесие на контакте порода – вода резко нарушается, а отношение активностей 226Ra/238U в рассолах может достигать 102-104.
 Анилин (амидобензол, аминобензол, фениламин)
Анилин (амидобензол, аминобензол, фениламин) Уравнение состояния
Уравнение состояния от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой
от греч. Hydro –вода, Lysis – разложение, распад Гидролиз – это реакция обменного разложения веществ водой Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Органическая химия
Органическая химия Химия – наука о веществах. Вычисления по химическим формулам. Тема 1
Химия – наука о веществах. Вычисления по химическим формулам. Тема 1 Классификация химических элементов
Классификация химических элементов Горные породы
Горные породы Chemické reakcie
Chemické reakcie Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу
Оңай балқитын флюстерді қолдана отырып хромкенді шекемтастар алу мүмкіндігін зерттеу Долговечность пластмасс
Долговечность пластмасс Основания. Состав оснований
Основания. Состав оснований Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл.
Изменения, происходящие с веществами Урок химии 8 класс Учитель химии МОУ «СОШ №7» г. Балаково Саратовская обл. Получение функциональных плёнок на основе TiO2
Получение функциональных плёнок на основе TiO2 Тема: Неметаллы
Тема: Неметаллы Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Вода и классы химических веществ
Вода и классы химических веществ Металлы
Металлы Céramiques lesquelles choisi ?
Céramiques lesquelles choisi ? Массовые доли растворенного вещества
Массовые доли растворенного вещества Ионная хроматография
Ионная хроматография Свойства растворов и их взаимодействие с газовой фазой
Свойства растворов и их взаимодействие с газовой фазой Презентация на тему Жидкие кристаллы
Презентация на тему Жидкие кристаллы  Окислительно-восстановительные реакции (ОВР). Лекция 1
Окислительно-восстановительные реакции (ОВР). Лекция 1 Применение неорганических соединений в пищевой промышленности
Применение неорганических соединений в пищевой промышленности Катализаторы и катализ
Катализаторы и катализ Сталь 12Х18Н10Т
Сталь 12Х18Н10Т Искусственные полимеры
Искусственные полимеры