Содержание
- 3. АЛКАНЫ Получение, нахождение в природе и применение алканов ВПЕРЕД НАЗАД
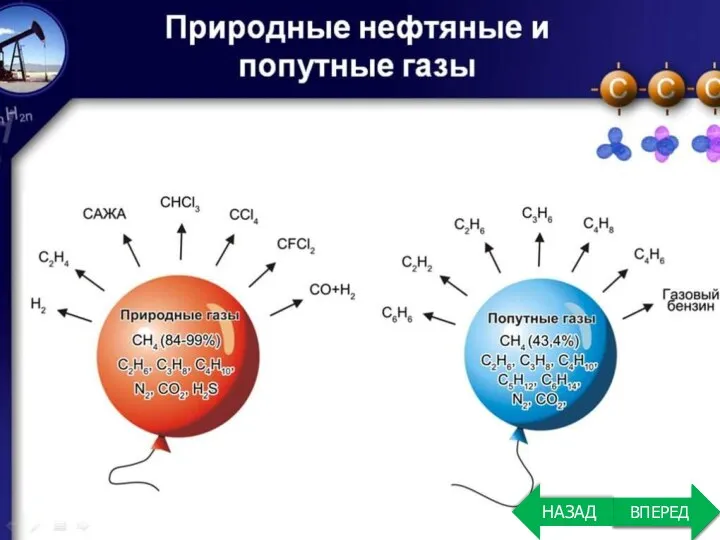
- 4. ВПЕРЕД Газообразные алканы получают из природного и попутного нефтяных газов; Жидкие и твердые – из нефти.
- 5. ВПЕРЕД Рудничный газ состоит из МЕТАНА Природный газ на 95% состоит из метана МЕТАН называют ещё
- 6. ВПЕРЕД 3. Изомеризация алканов: 4. Гидрирование непредельных углеводородов: ВПЕРЕД НАЗАД
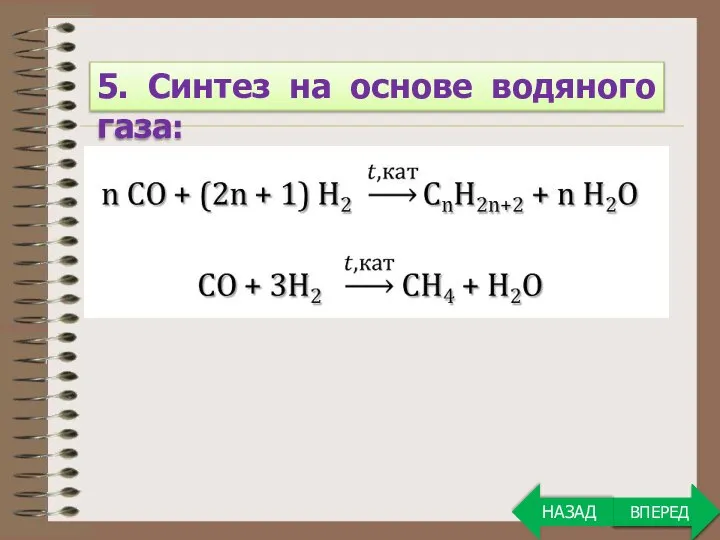
- 7. ВПЕРЕД 5. Синтез на основе водяного газа: ВПЕРЕД НАЗАД
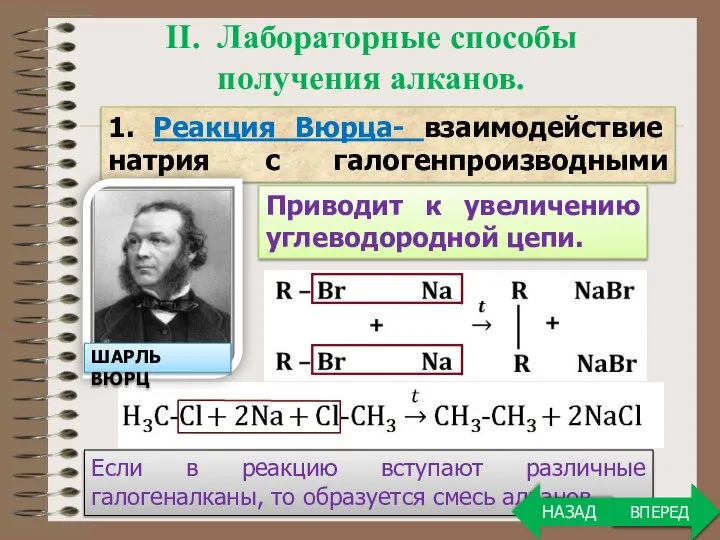
- 8. Если в реакцию вступают различные галогеналканы, то образуется смесь алканов. ВПЕРЕД II. Лабораторные способы получения алканов.
- 9. ВПЕРЕД 2. Реакция Дюма - сплавление солей карбоновых кислот со щелочью.
- 10. 3. Синтез Кольбе - электролиз солей карбоновых кислот. 4. Гидролиз карбидов металлов. Al4C3 + 12H2O →
- 11. Применение АЛКАНОВ ВПЕРЕД НАЗАД
- 12. тетрахлорметан – растворитель, для гашения пламени; фтор-, хлор- углеводороды (фреоны) – хладагенты, производство аэрозолей, производство тефлона.
- 13. ВПЕРЕД Метан– получение сажи для типографской краски, резины, синтез водорода, производство ацетилена, формальдегида. Применение алканов ВПЕРЕД
- 14. ВПЕРЕД ВПЕРЕД НАЗАД
- 15. Твердые алканы встречаются в природе в виде залежей горного воска – озокерита, в восковых покрытиях листьев,
- 16. АЛКЕНЫ Получение и применение алканов ВПЕРЕД НАЗАД
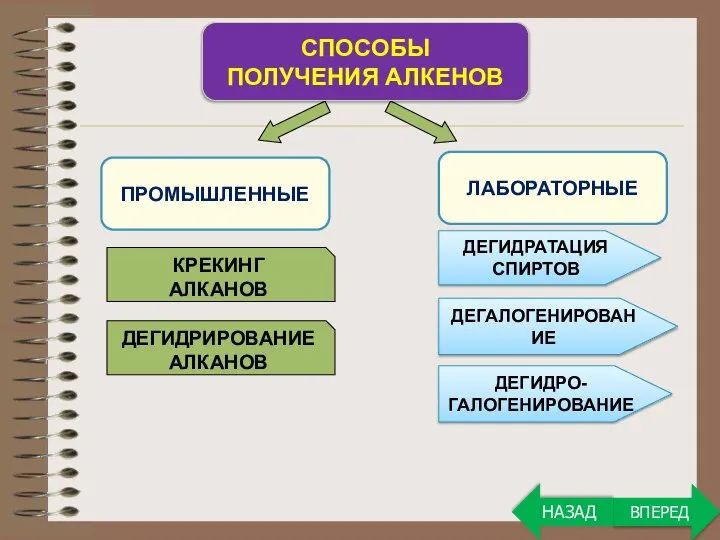
- 17. ПРОМЫШЛЕННЫЕ СПОСОБЫ ПОЛУЧЕНИЯ АЛКЕНОВ ЛАБОРАТОРНЫЕ КРЕКИНГ АЛКАНОВ ДЕГИДРИРОВАНИЕ АЛКАНОВ ДЕГИДРАТАЦИЯ СПИРТОВ ДЕГАЛОГЕНИРОВАНИЕ ДЕГИДРО- ГАЛОГЕНИРОВАНИЕ ВПЕРЕД НАЗАД
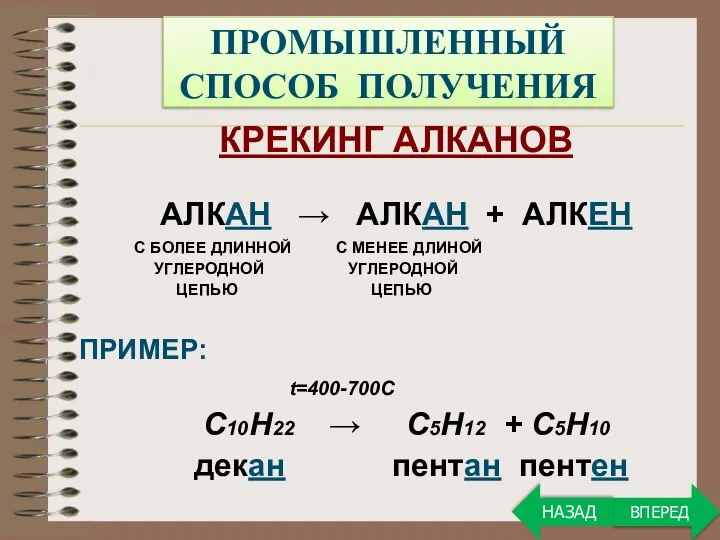
- 18. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ КРЕКИНГ АЛКАНОВ АЛКАН → АЛКАН + АЛКЕН С БОЛЕЕ ДЛИННОЙ С МЕНЕЕ ДЛИНОЙ
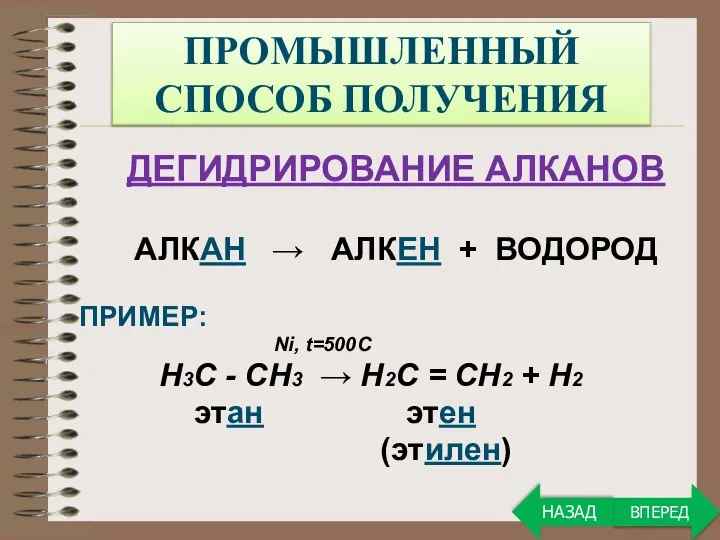
- 19. ПРОМЫШЛЕННЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРИРОВАНИЕ АЛКАНОВ АЛКАН → АЛКЕН + ВОДОРОД ПРИМЕР: Ni, t=500C Н3С - СН3
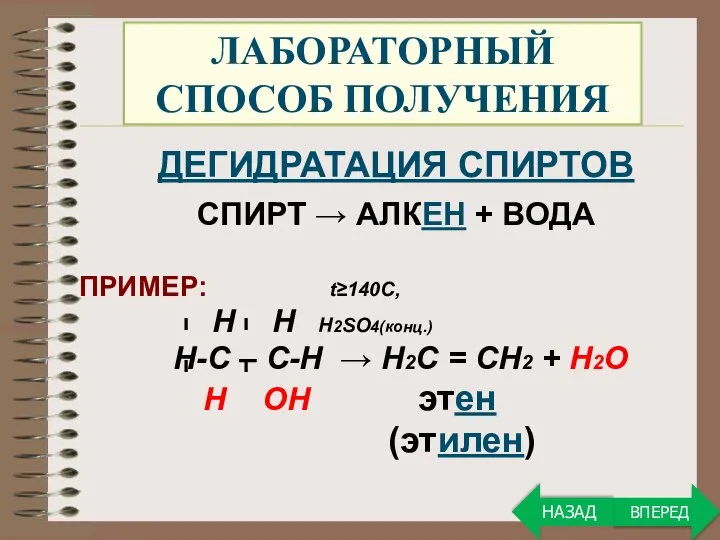
- 20. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРАТАЦИЯ СПИРТОВ СПИРТ → АЛКЕН + ВОДА ПРИМЕР: t≥140C, Н Н Н2SO4(конц.) Н-С
- 21. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГАЛОГЕНИРОВАНИЕ ПРИМЕР: t Н2С – СН2 + Zn → Н2С = СН2 +
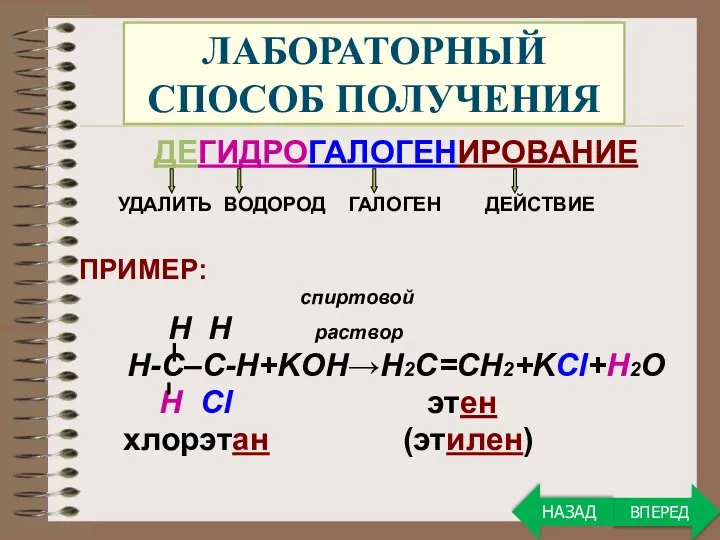
- 22. ЛАБОРАТОРНЫЙ СПОСОБ ПОЛУЧЕНИЯ ДЕГИДРОГАЛОГЕНИРОВАНИЕ УДАЛИТЬ ВОДОРОД ГАЛОГЕН ДЕЙСТВИЕ ПРИМЕР: спиртовой H H раствор Н-С–С-Н+KOH→Н2С=СН2+KCl+H2O Н Cl
- 23. Применение алкенов ВПЕРЕД НАЗАД
- 24. АЛКИНЫ Получение и применение алканов ВПЕРЕД НАЗАД
- 25. Получение АЛКИНОВ 1) В промышленности ацетилен получают высокотемпературным пиролизом метана. 1500ºС 2CH4 → HC≡CH + 3H2
- 26. 4) Алкины можно получить дегидрогалогенированием дигалогенопроизводных парафинов. Атомы галогена при этом могут быть расположены как у
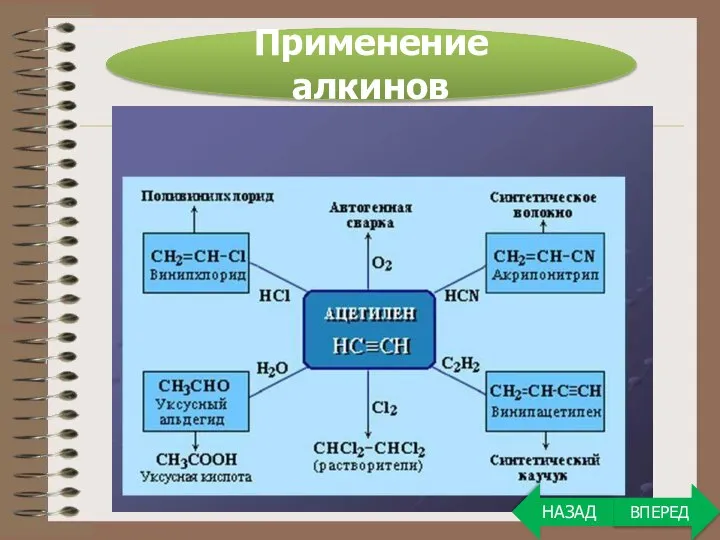
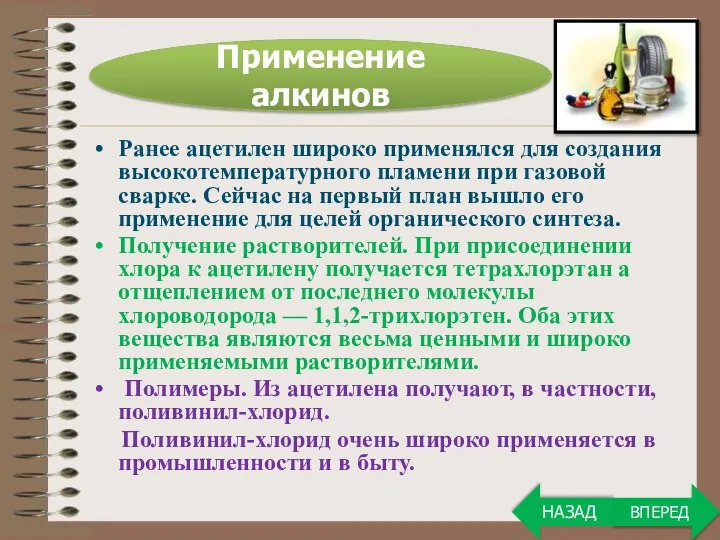
- 27. Применение алкинов ВПЕРЕД НАЗАД
- 28. Ранее ацетилен широко применялся для создания высокотемпературного пламени при газовой сварке. Сейчас на первый план вышло
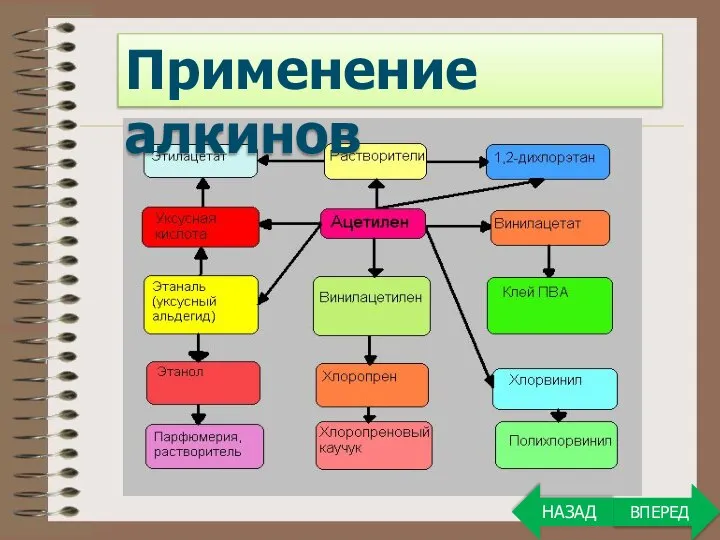
- 29. Применение алкинов ВПЕРЕД НАЗАД
- 31. Скачать презентацию
















 Природные смолы: канифоль, янтарь, сандарак (2)
Природные смолы: канифоль, янтарь, сандарак (2) Окислительно-восстановительные реакции
Окислительно-восстановительные реакции 1666603286718__4v20ts
1666603286718__4v20ts Введение в органическую химию
Введение в органическую химию Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент
Вещество и тело. Атом и молекула. Свойства веществ. Простые и сложные вещества. Химический элемент Этиленовые углеводороды
Этиленовые углеводороды Введение в биохимию
Введение в биохимию Классы неорганических соединений
Классы неорганических соединений Окислительные свойства концентрированной серной кислоты
Окислительные свойства концентрированной серной кислоты Классы неорганических веществ. Оксиды
Классы неорганических веществ. Оксиды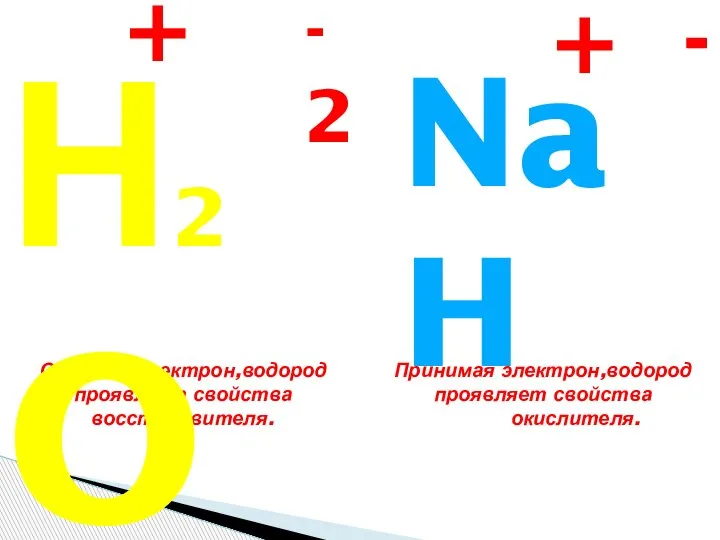 Кислород и водород
Кислород и водород Степень окисления веществ
Степень окисления веществ Альдегиды. Свойства альдегидов
Альдегиды. Свойства альдегидов Углеводороды
Углеводороды Алканы. Химические свойства. Применение
Алканы. Химические свойства. Применение Важнейшие классы неорганических соединений
Важнейшие классы неорганических соединений Основания. Получение оснований
Основания. Получение оснований Высшие жирные кислоты липиды биомембраны. Лекция 3
Высшие жирные кислоты липиды биомембраны. Лекция 3 Свойства нефти
Свойства нефти Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме
Масс-спектрометрия – аналитический метод определения молекулярной массы свободных ионов в высоком вакууме Уравнение состояния идеального газа. Газовые законы. Изопроцессы
Уравнение состояния идеального газа. Газовые законы. Изопроцессы Гідроліз солей
Гідроліз солей Соединения щелочных металлов
Соединения щелочных металлов Презентация на тему Азотная кислота (9 класс)
Презентация на тему Азотная кислота (9 класс)  Первоначальные химические понятия. 2 раунд
Первоначальные химические понятия. 2 раунд Реакции ионного обмена
Реакции ионного обмена Нитраты в продуктах
Нитраты в продуктах Основные классы неорганических соединений
Основные классы неорганических соединений