Слайд 33
Электрический ток
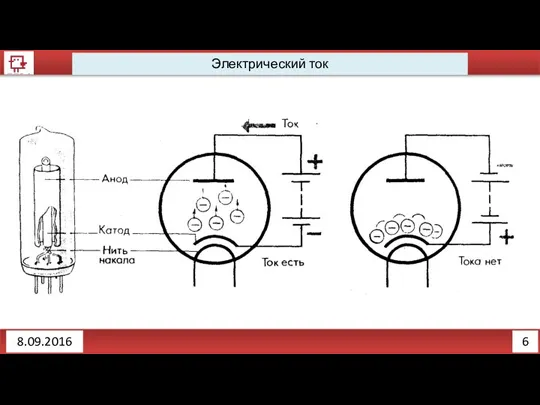
Электрический ток - направленное (упорядоченное) движение заряженных частиц.
Какие заряженные частицы мы
Слайд 44
Электрический ток
8.09.2016
Электрический ток - направленное (упорядоченное) движение заряженных частиц.
Какие заряженные частицы мы
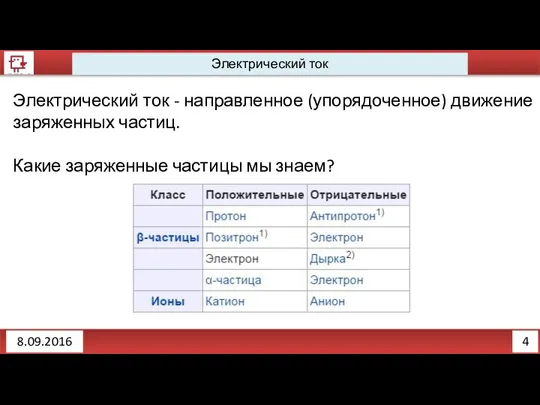
знаем?
Слайд 55
Электрический ток
8.09.2016
Электрический ток - направленное (упорядоченное) движение заряженных частиц.
Какие заряженные частицы мы
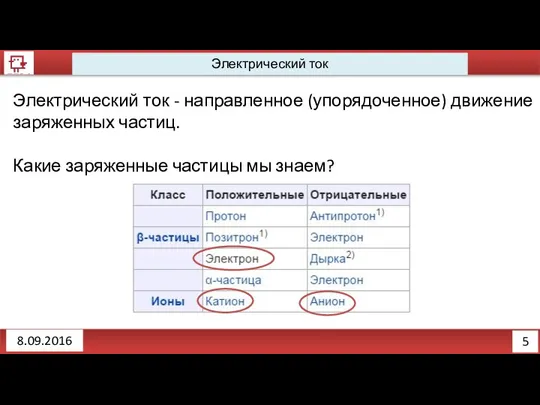
знаем?
Слайд 88
Электролиты
8.09.2016
Итак, некоторые растворы проводят электрический ток.
Например, раствор NaCl.
А некоторые растворы ток
не проводят, например, сахара, спирта, кислорода.
Растворы проводящие ток называются растворами электролитов.
Дело в том, что некоторые соли способны диссоциировать!
Слайд 99
Электролиты
8.09.2016
Когда электролит попадает в воду он «разваливается» на составляющие его катионы и

анионы.
NaCl = Na+ + Cl-
CH3COOH =H+ + CH3COO-
Слайд 1010
Растворение
8.09.2016
NaCl = Na+ + Cl-
Долгое время считалось, что процесс растворения имеет только

физическую природу.
Например, при разбавлении серной кислоты сосуд со смесью нагревается. Поэтому существует правило:
серную кислоту наливают тонкой струйкой в воду при постоянном перемешивании!
Слайд 1111
Вода как растворитель
8.09.2016
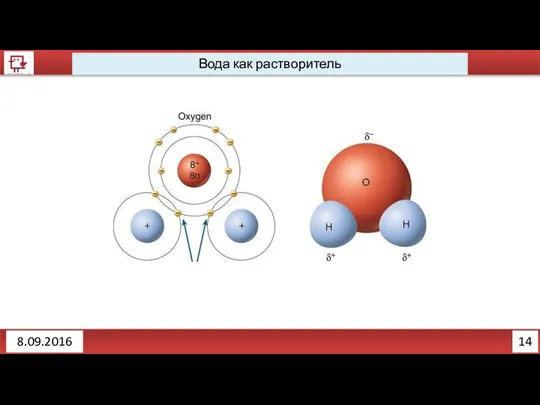
Почему вода растворитель?

Слайд 1212
Вода как растворитель
8.09.2016

Слайд 1314
Вода как растворитель
8.09.2016
Слайд 1414
Вода как растворитель
8.09.2016
Вещества с какой связь лучше будут растворяться в воде?
С ковалентной

неполярной
С ковалентной полярной
С ионной
С металлической












 Презентация на тему Химические свойства бензола. Получение, применение
Презентация на тему Химические свойства бензола. Получение, применение  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции ЗАДАЧИ 9 класс
ЗАДАЧИ 9 класс Современное представление о строении атома, S- и P- орбитали
Современное представление о строении атома, S- и P- орбитали Конструкционные и специальные материалы холодильной техники
Конструкционные и специальные материалы холодильной техники Лаки. Эмали. Красочные составы
Лаки. Эмали. Красочные составы Фарфор и фаянс
Фарфор и фаянс Для чего нужна нефть
Для чего нужна нефть Генетическая связь между классами неорганических соединений
Генетическая связь между классами неорганических соединений Вдоль по радуге
Вдоль по радуге Периодический закон и периодическая система элементов Д.И. Менделеева
Периодический закон и периодическая система элементов Д.И. Менделеева Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"
Презентация по Химии "Химические задачи как средство гуманизации обучения учащихся на уроках химии"  Актуальные вопросы биохимии спорта. Лекция 2
Актуальные вопросы биохимии спорта. Лекция 2 Салқындатқыш агенттер
Салқындатқыш агенттер К 180-летию со дня рождения Д.И. Менделеева
К 180-летию со дня рождения Д.И. Менделеева Презентация на тему Характеристика щелочных металлов 9 класс
Презентация на тему Характеристика щелочных металлов 9 класс  Валентность
Валентность Первые химические символы
Первые химические символы Промышленный метод получения ацетилена
Промышленный метод получения ацетилена Chemsheets AS 1009 (Electron arrangement)
Chemsheets AS 1009 (Electron arrangement) Побочная подгруппа VII группы периодической системы
Побочная подгруппа VII группы периодической системы Кислоты. 8 класс
Кислоты. 8 класс Характеристика кислорода и серы
Характеристика кислорода и серы Ковалентная неполярная связь
Ковалентная неполярная связь Строение и номенклатура карбонильных соединений
Строение и номенклатура карбонильных соединений Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ
Окислительно- восстановительные реакции в органической химии. Подготовка к ЕГЭ Строение электронных оболочек
Строение электронных оболочек Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты
Взаимодействие карбонатов с разбавленными кислотами. Качественные реакции на карбонаты