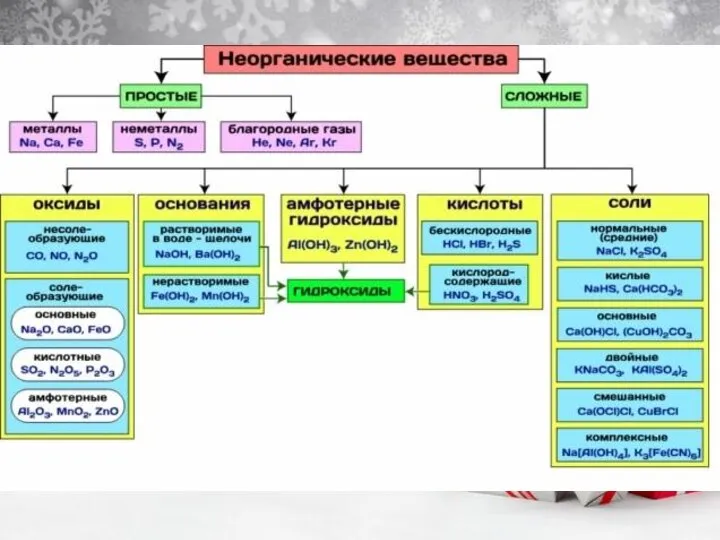
наизусть: С (алмаз, графит), В (бор), Si (кремний), SiO2 (кварц, речной песок), Al2O3 (корунд, боксит, глинозем, рубин, сапфир); Ионная - В ионной кристаллической решетке в узлах есть КАТИОНЫ (положительно заряженные ионы) и АНИОНЫ (отрицательно заряженные ионы) (например, в солях, в гидридах металлов, оксиды металлов); Металлическая (металлы); Молекулярная (все кроме предыдущих 3 , встречается чаще всего, чаще всего газы или жидкости, простые двухатомные вещества – галогены, кислород, азот и.д.)
Смотрим задание – Na2O – ионная, I2 – молекулярная; KCl – ионная; SiO2 - атомная; H2O – молекулярная.
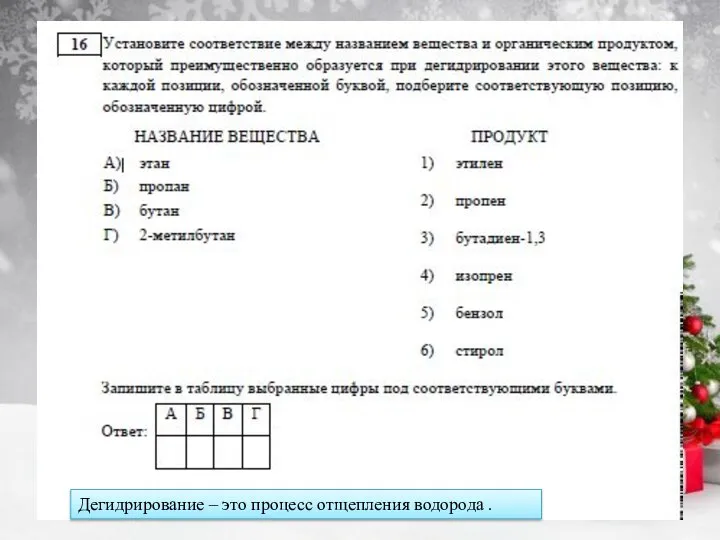
Задание 5 - вспоминаем типы веществ – картинка на сл.слайде (напоминание). Рассмотрим пункт В) H2SO4 – двухосновная кислота( два атома водорода), тогда по такой логике H3PO4 – трёхосновная КАК и полагается (структура дальше), тогда если бы у нас был в задании ГИДРОфосфат натрия – это была бы также КИСЛАЯ соль, а Дигидрофосфат – КИСЛАЯ соль.
Но есть две кислоты фосфора, у которых что-то пошло не так и у них , когда в составе есть один атом водорода , то это не кислая, а Средняя соль – всё покажу дальше)



































 Карбоновые кислоты (химические свойства)
Карбоновые кислоты (химические свойства) Металлургия
Металлургия Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Физические свойства металлов
Физические свойства металлов Своя игра. Химические элементы
Своя игра. Химические элементы Технология получения полиуретанов
Технология получения полиуретанов Степень окисления. Электроотрицательность. Формулы бинарных соединений
Степень окисления. Электроотрицательность. Формулы бинарных соединений Школа юных ученых. Соль
Школа юных ученых. Соль Химический состав продуктов питания
Химический состав продуктов питания Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз
Совершенствование железооксидного катализатора дегидрирования за счет стабилизации ферритных фаз Вода… Химические названия
Вода… Химические названия Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Метаболизм триацилглицеринов
Метаболизм триацилглицеринов Оксид лития
Оксид лития Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"
Презентация по Химии "Исследование влияния токсикантов на активность ферментов на примере уреазы"  Получение и применение алкенов
Получение и применение алкенов Кислород (Лекция 7)
Кислород (Лекция 7) Контрольна робота, хімія
Контрольна робота, хімія Основы химической кинетики
Основы химической кинетики Осуществление цепочки химических превращений. Практическая работа №1
Осуществление цепочки химических превращений. Практическая работа №1 Презентация на тему Химия в разных науках
Презентация на тему Химия в разных науках  Способы получения металлов
Способы получения металлов Получение и применение аренов
Получение и применение аренов Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В.
Алканы в торфянисто-подзолисто-глееватых почвах Габов Д.Н., Безносиков В.А., Кондратенок Б.М., Груздев И.В. Искусственные и синтетические ткани
Искусственные и синтетические ткани Простые и сложные вещества (8 класс)
Простые и сложные вещества (8 класс) 7 Классиф неорг веществ презентация 2 (1)
7 Классиф неорг веществ презентация 2 (1)