Содержание
- 2. Теория активных столкновений В теории активных столкновений считается, что акт превращения начальных веществ в конечные продукты
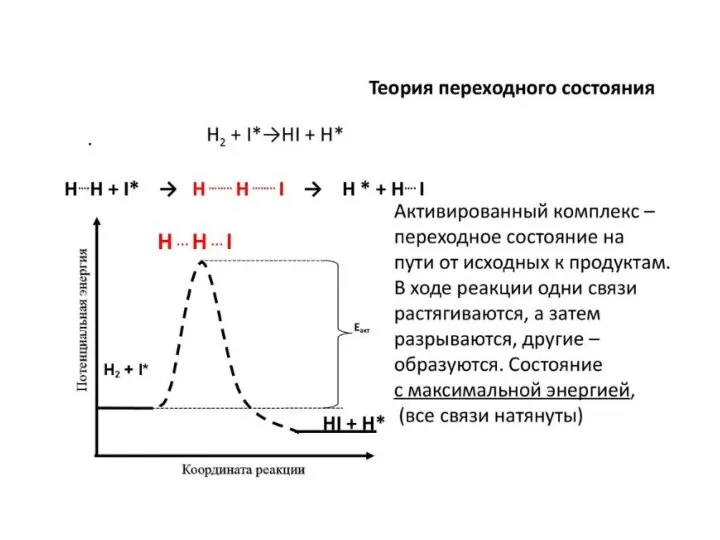
- 3. Теория активированного комплекса (АК) или теория переходного состояния. Основные положения. 1. Превращение проходит через образование АК
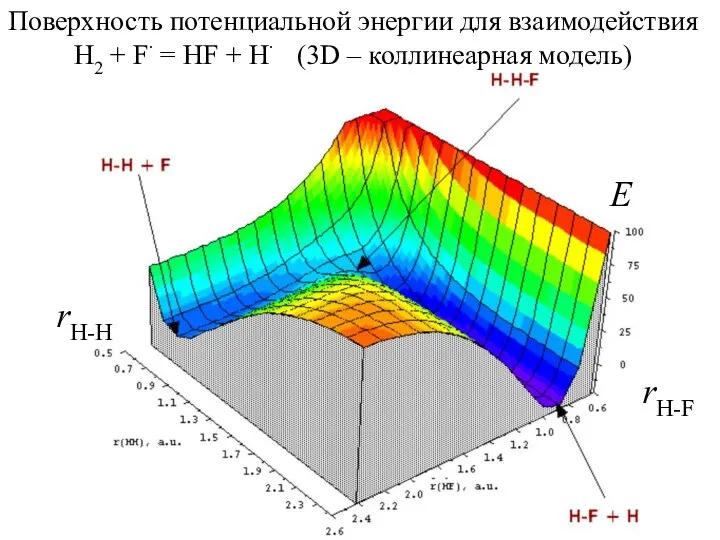
- 4. Поверхность потенциальной энергии для взаимодействия H2 + F∙ = HF + H∙ (3D – коллинеарная модель)
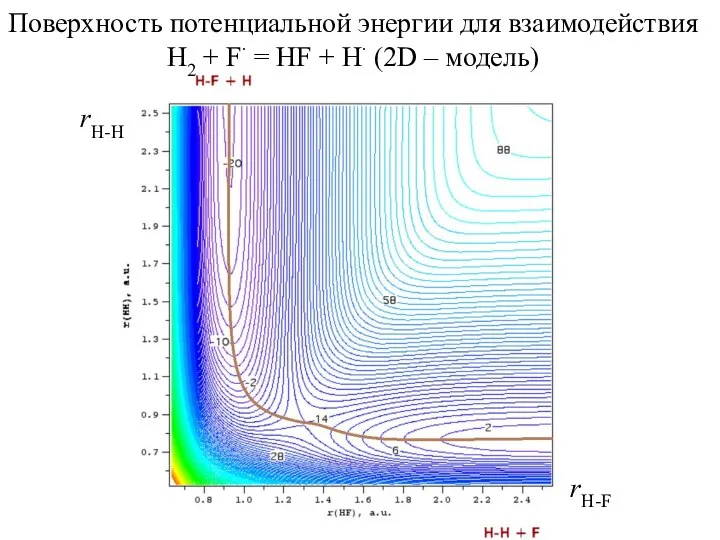
- 5. Поверхность потенциальной энергии для взаимодействия H2 + F∙ = HF + H∙ (2D – модель) rH-H
- 8. Скачать презентацию


 Презентация на тему Полисахариды
Презентация на тему Полисахариды  Дисахариды и полисахариды
Дисахариды и полисахариды Предельные углеводороды - алканы
Предельные углеводороды - алканы Элемент первой группы, калий
Элемент первой группы, калий Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас
Окисно-відновні реакції. Процеси окиснення та відновлення, окисники та відновники. 9 клас Предмет химии, простые и сложные вещества
Предмет химии, простые и сложные вещества Значение химии в медицине
Значение химии в медицине Промышленный биокатализ
Промышленный биокатализ Контрольна робота, хімія
Контрольна робота, хімія Водород. История открытия
Водород. История открытия Презентация на тему Процессы в растворах электролитическая диссоциация
Презентация на тему Процессы в растворах электролитическая диссоциация  Оксиды
Оксиды Синтетические моющие средства (СМС). Наша стирка по-байкальски
Синтетические моющие средства (СМС). Наша стирка по-байкальски География. Уральские самоцветы
География. Уральские самоцветы Термохимия. Задания
Термохимия. Задания Čo sú chemické reakcie
Čo sú chemické reakcie Амины
Амины Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6
Изотерма адсорбции. Связь изотермы, изопикны и изостеры адсорбции. Закон Генри. Лекция 6 Металловедение
Металловедение Химическая термодинамика. Экзаменационные вопросы
Химическая термодинамика. Экзаменационные вопросы Серная кислота
Серная кислота Альдегиды и кетоны (часть 2)
Альдегиды и кетоны (часть 2) Галогеноалканы: получение, свойства и применение
Галогеноалканы: получение, свойства и применение Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Электроотрицательность (ЭО)
Электроотрицательность (ЭО) Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю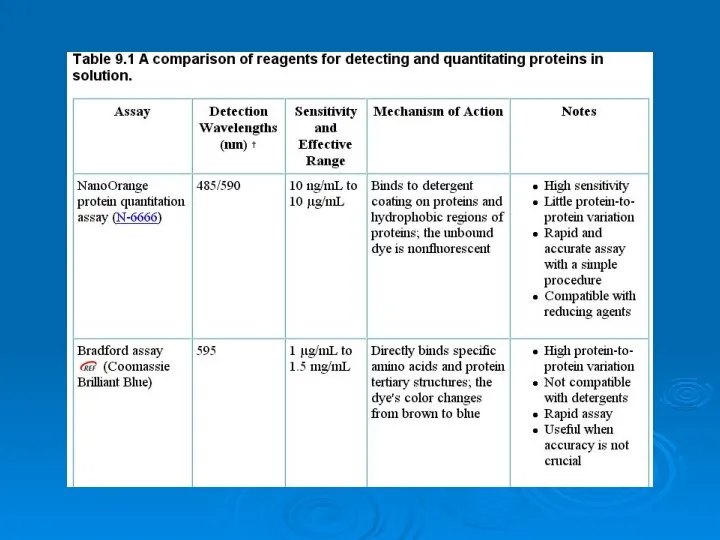 Analysis of proteins
Analysis of proteins Физические механизмы образования кристаллов
Физические механизмы образования кристаллов