Содержание
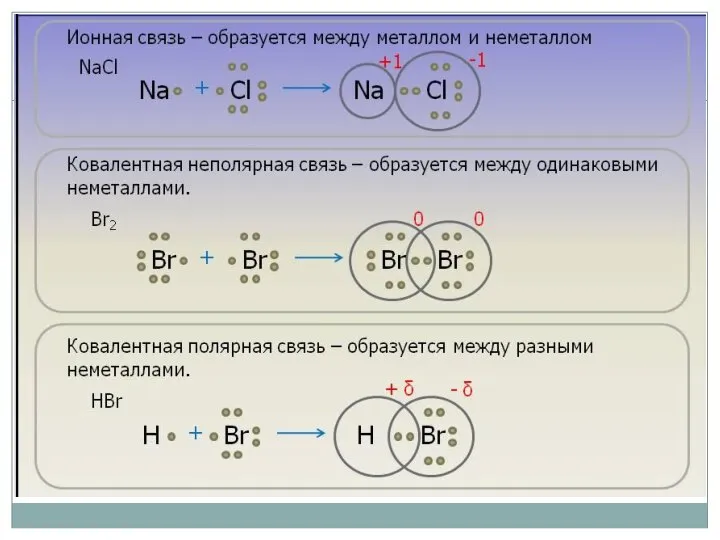
- 2. Ответьте на вопросы: Какие виды химической связи вы знаете? Перечислите их. Что такое «ионная связь»? Между
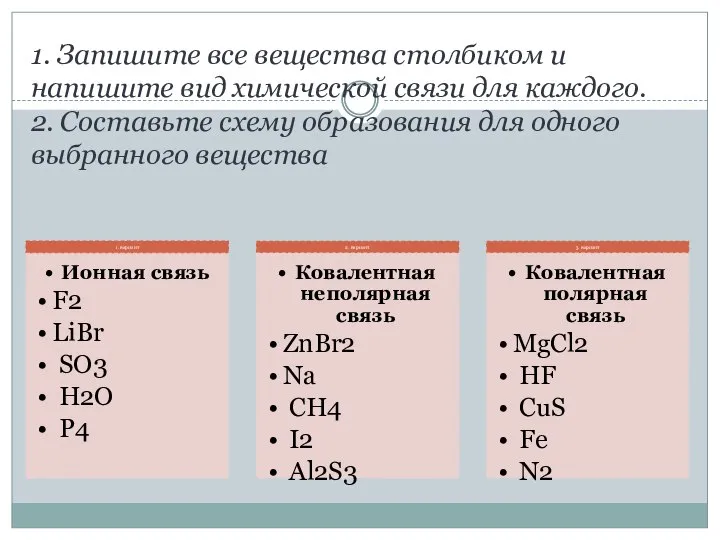
- 4. 1. Запишите все вещества столбиком и напишите вид химической связи для каждого. 2. Составьте схему образования
- 6. Тема урока: Вода. Растворы. Растворение.
- 7. Тема урока: Вода. Растворы. Растворение.
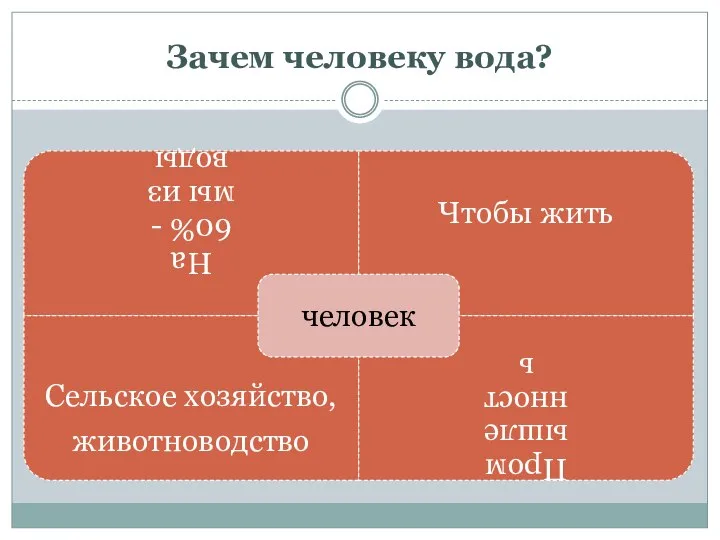
- 8. Зачем человеку вода? Прочитайте текст, определите 4 важные области применения
- 9. Зачем человеку вода?
- 10. Вода – универсальный растворитель, так как растворяет большое количество веществ.
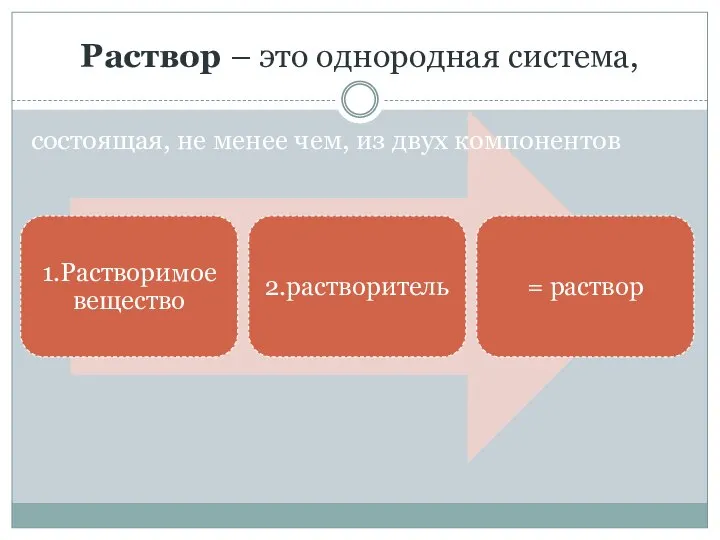
- 11. Раствор – это однородная система, состоящая, не менее чем, из двух компонентов
- 12. Растворение – это физико-химический процесс
- 13. Растворимость – это способность вещества разрушаться до молекул или ионов.
- 14. Растворимость веществ.
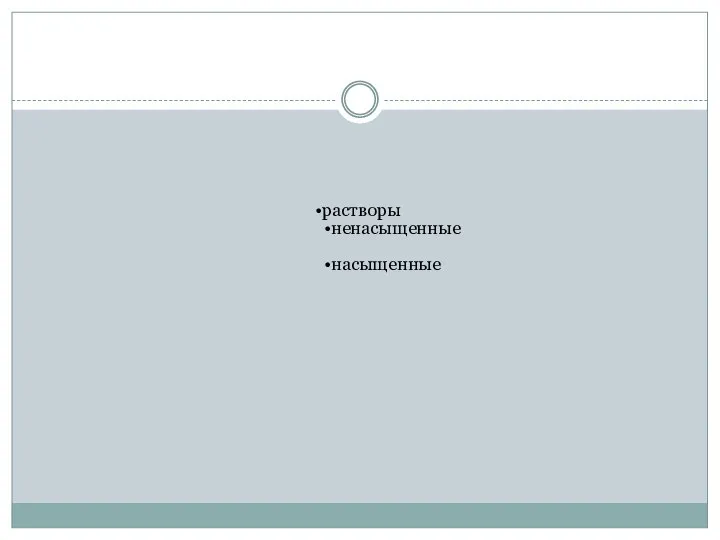
- 16. растворы ненасыщенные насыщенные
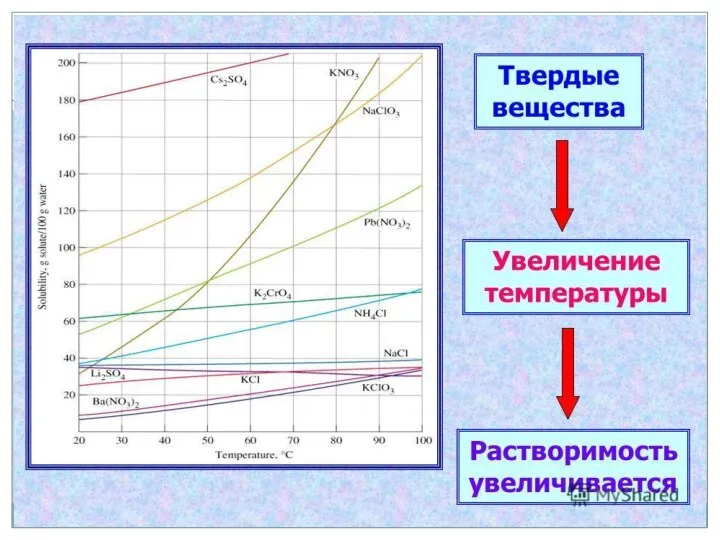
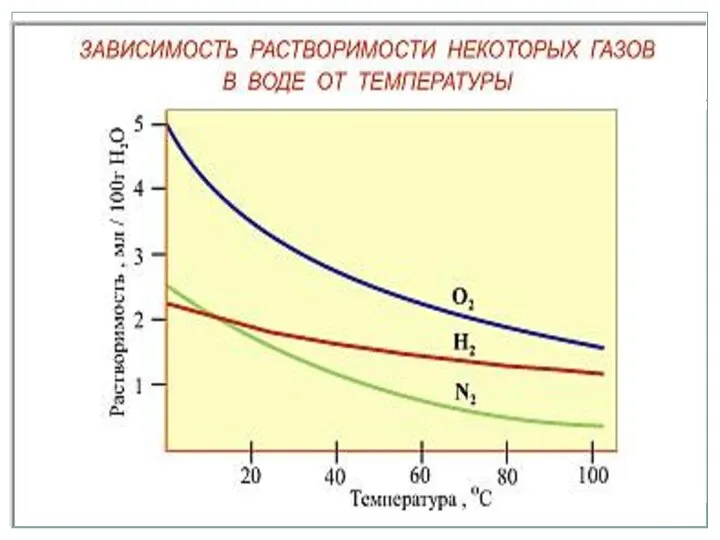
- 17. Как зависит растворимость твердых веществ от температуры?
- 20. вода и другая жидкость: нерастворимость друг в друге (ртуть - вода) неограниченная смешиваемость (ацетон - вода).
- 21. Станция водоподготовки для гальванического цеха
- 24. Применение воды в технических целях. для охлаждения оборудования, сырья для мойки для растворения реагентов, используемых в
- 25. Для выражения состава раствора используют количественную характеристику раствора
- 26. Массовая доля растворенного вещества: ( Ѡ р.в. ) - это безразмерная величина, равная отношению массы растворённого
- 27. Массовую долю растворённого вещества (процентную концентрацию) обычно выражают в долях единицы или в процентах. Например, массовая
- 28. Раствор хлорида кальция 10 % для инъекций Ѡ CaCl2 = 0,1 (10%) Ионы кальция необходимы для
- 29. Пример решения задачи: Сколько грамм соли и воды нужно для приготовления 300 г 5% раствора? Дано:
- 30. Решение: m (соль) 1) Ѡ (соль) = ----------------- m (р-ра) 2) m (соль) = Ѡ (соль)
- 31. Подведем итоги О чем вы узнали сегодня на занятии? (см. название темы занятия)
- 33. Скачать презентацию






















 Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Растворимость веществ. Кристаллогидраты
Растворимость веществ. Кристаллогидраты Комплексное задание по дисциплине основы материаловедения для группы 18
Комплексное задание по дисциплине основы материаловедения для группы 18 Полимеры. Функции полимеров
Полимеры. Функции полимеров Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева
Галогены. Элементы главной подгруппы 7 группы Периодической системы Менделеева Периодический закон. Периодическая таблица химических элементов. 8 класс
Периодический закон. Периодическая таблица химических элементов. 8 класс Основания. Получение оснований
Основания. Получение оснований Щелочные металлы
Щелочные металлы Периодический закон и Периодическая система химических элементов Д. И. Менделеева
Периодический закон и Периодическая система химических элементов Д. И. Менделеева Химия. Вопросы. Практическая работа
Химия. Вопросы. Практическая работа lektsia_7
lektsia_7 Кристаллы
Кристаллы Новые грани парфюмерии. Задача 5
Новые грани парфюмерии. Задача 5 Изготовление искусственного янтаря
Изготовление искусственного янтаря Вспоминаем химию
Вспоминаем химию Химическое ассорти
Химическое ассорти Строение электронных оболочек атомов химических элементов
Строение электронных оболочек атомов химических элементов Железо
Железо Важнейшие классы неорганических соединений. Соли
Важнейшие классы неорганических соединений. Соли Соединения серы
Соединения серы Химия в моей специальности
Химия в моей специальности Презентация на тему Бинарные соединения
Презентация на тему Бинарные соединения  Презентация на тему Поверхностно-активные вещества
Презентация на тему Поверхностно-активные вещества  Амины
Амины Присоединение аммиака и аминов
Присоединение аммиака и аминов Щелочные металлы
Щелочные металлы Опыты с хондроитин сульфатом
Опыты с хондроитин сульфатом Тестовые задания. Атомы
Тестовые задания. Атомы