Содержание
- 2. Загадочны морей просторы… Что там – под толщей темных вод? Долины, впадины, и горы Веществ сплошной
- 3. Маршрут нашего путешествия 1 2 3 4 5 Залив Информационный Стоп! Опасно! Бермудский треугольник Гавань Индикаторно
- 4. Залив Информационный План Знакомство с морем кислот; Разнообразие кислот; Получение кислот.
- 5. Знакомство с морем кислот
- 6. Разнообразие кислот Немало кислот содержится в нашей пище и лекарствах. Фрукты, овощи, молочные продукты, соусы, приправы
- 7. Природные кислоты Яблочная Лимонная Аскорбиновая кислота витамин С Аскорбиновая кислота витамин С Муравьиная кислота Щавелевая кислота
- 8. Получение кислот СО2 + Н2О Н2СО3 →
- 9. Стоп! Опасно! Бермудский треугольник Техника безопасности при обращении с кислотами; Оказание первой помощи; 3. Физические свойства
- 10. Техника безопасности
- 11. Запомни! Сначала вода, затем кислота Иначе может случиться беда!
- 12. Оказание первой помощи при ожогах кислотой
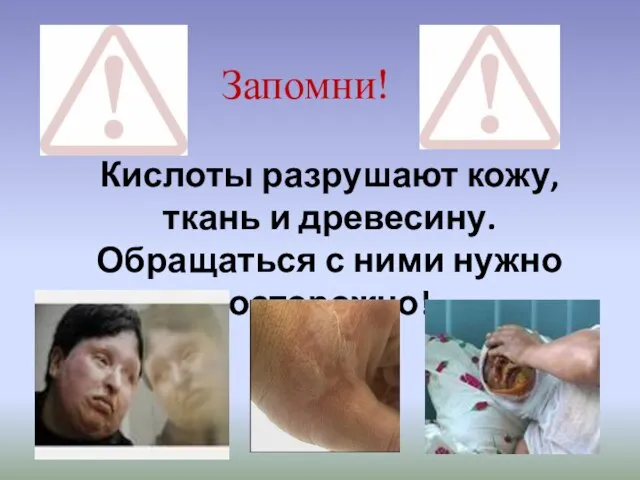
- 13. Запомни! Кислоты разрушают кожу, ткань и древесину. Обращаться с ними нужно осторожно!
- 14. Физические свойства кислот
- 15. Отдохнем? Смотрим, слушаем и повторяем! Море, море – мир бездомный, Пенный шелест волн прибрежных. Над тобой
- 16. Гавань Индикаторно - экспериментальная Химические свойства кислот; Открытие индикаторов; Исследование химических свойств кислот индикаторами. План
- 17. Химические свойства кислот Кислоты реагируют: С металлами (образуется соль и водород). С основными оксидами (образуется соль
- 18. Открытие индикаторов Постепенно химики научились распознавать кислоты. Однажды английский химик Р. Бойль, изучая свойства соляной кислоты,
- 19. Запомни! Индикаторы краснеют в кислотах, т.е. в кислой среде!
- 20. Запомни! Кислоты, полученные в лаборатории и кислоты в продуктах питания проявляют общие химические свойства!
- 21. Бухта Применения Угольная кислота; Серная кислота; Ортофосфорная кислота; Азотная кислота; Соляная кислота. План Н2СО3 Н2SО4 Н3PО4
- 22. Угольная кислота Н2CО3
- 23. Серная кислота Н2SО4 Серную кислоту применяют: в производстве минеральных удобрений; как электролит в свинцовых аккумуляторах; для
- 24. Ортофосфорная кислота Н3РО Ортофосфорную кислоту применяют: при пайке в качестве флюса (по окисленой меди, по чёрному
- 25. Азотная кислота НNО3 Азотная кислота применяется: в производстве минеральных удобрений; в военной промышленности; в фотографии —
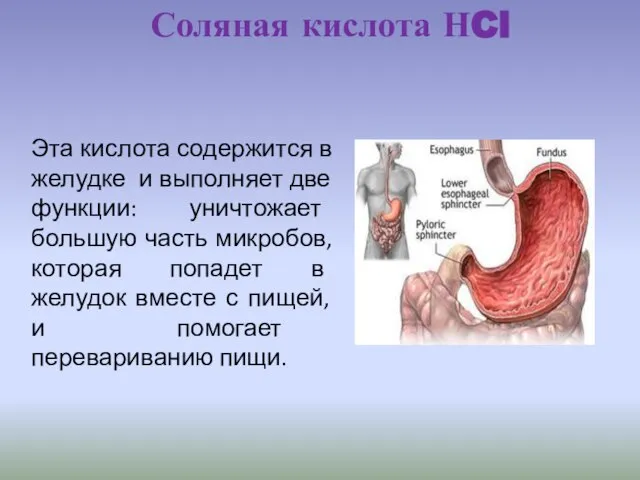
- 26. Эта кислота содержится в желудке и выполняет две функции: уничтожает большую часть микробов, которая попадет в
- 27. Пролив Закрепления План Химические реакции; Найди соответствие.
- 28. АI + HCI = AICI2+ H2↑ Mg + H2CO3 = MgCO3 + H2↑ Zn + H2SO4
- 30. Скачать презентацию

























 Взвешивание. Аналитические весы
Взвешивание. Аналитические весы Электролитическая диссоциация уксусной и муравьиной кислоты
Электролитическая диссоциация уксусной и муравьиной кислоты Металлическая и водородная и химическая связь
Металлическая и водородная и химическая связь Нуклеиновые кислоты
Нуклеиновые кислоты Химическая школа ДПИ НГТУ
Химическая школа ДПИ НГТУ Презентация на тему Электролиз
Презентация на тему Электролиз  Получение метанола из синтез-газа
Получение метанола из синтез-газа Презентация на тему Основные положения МКТ
Презентация на тему Основные положения МКТ  Загадочный фосфор
Загадочный фосфор Фосфор в природе
Фосфор в природе Формирование УУД на уроках химии
Формирование УУД на уроках химии Моделирование состава биоплёночного материала
Моделирование состава биоплёночного материала Металлы. Обобщающий урок
Металлы. Обобщающий урок Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства
Классификация гетероциклических соединений на основе их химического строения. Противоопухолевые средства Её величество – вода Интегрированный урок химии в 8 классе
Её величество – вода Интегрированный урок химии в 8 классе Закономерности изменения свойств галогенов
Закономерности изменения свойств галогенов Калий. В природе
Калий. В природе Презентация на тему Полимеры
Презентация на тему Полимеры  Рений. Содержание рения в земной коре
Рений. Содержание рения в земной коре Химические формулы
Химические формулы Диспропроциялану реакциялары
Диспропроциялану реакциялары Метод валентных связей
Метод валентных связей Амины
Амины Нефть
Нефть Окислительно-восстановительные реакции, 9 класс
Окислительно-восстановительные реакции, 9 класс Кислоты
Кислоты Липиды. Состав липидов
Липиды. Состав липидов Типы химической связи и виды кристаллических решеток
Типы химической связи и виды кристаллических решеток