Содержание
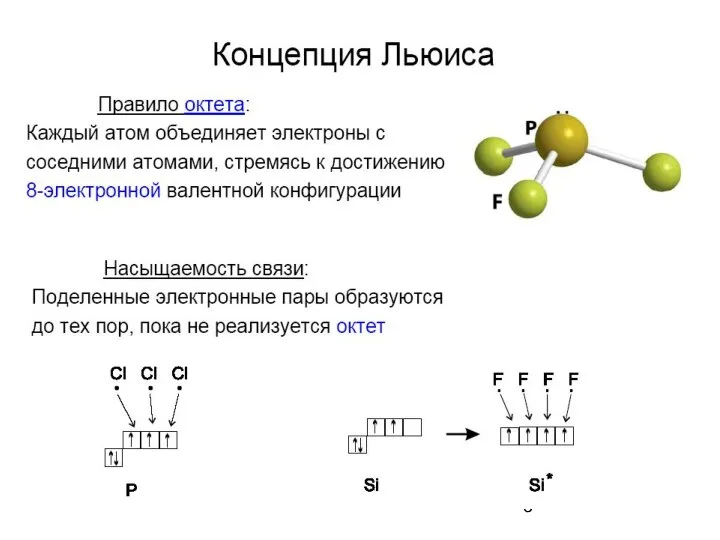
- 2. Метод валентных связей (МВС) иначе называют теорией локализован-ных электронных пар. В основе метода лежит предположение, что
- 5. Возбужденные состояния атомов образуются из основного состояния при переходе одного или нескольких электронов с занятых орбиталей
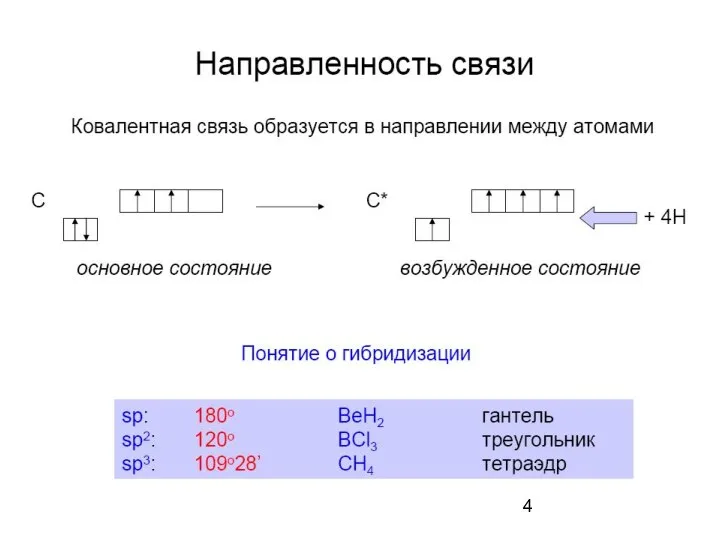
- 6. Гибридизация атомных орбиталей – изменение формы и энергии орбиталей атома при образовании ковалентной связи для достижения
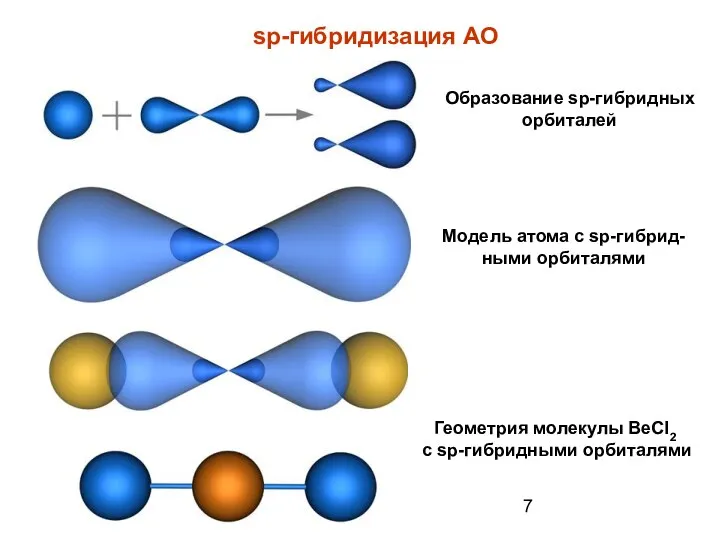
- 7. sp-гибридизация АО Образование sp-гибридных орбиталей Модель атома с sp-гибрид-ными орбиталями Геометрия молекулы BeCl2 с sp-гибридными орбиталями
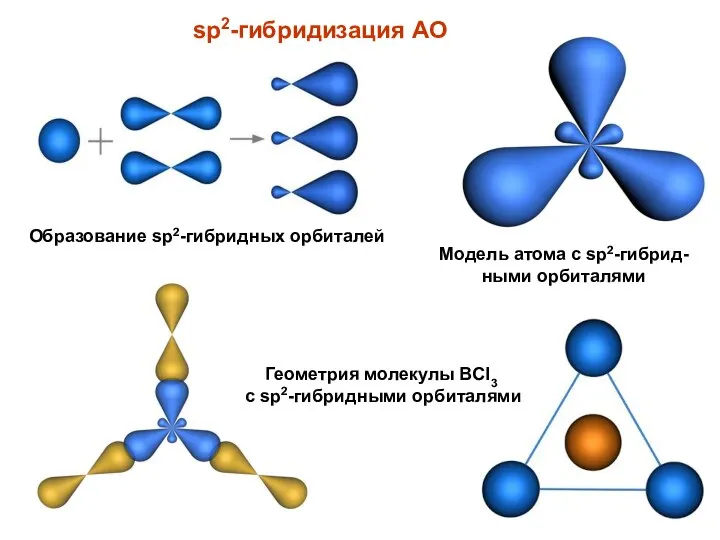
- 8. sp2-гибридизация АО Образование sp2-гибридных орбиталей Модель атома с sp2-гибрид-ными орбиталями Геометрия молекулы BCl3 с sp2-гибридными орбиталями
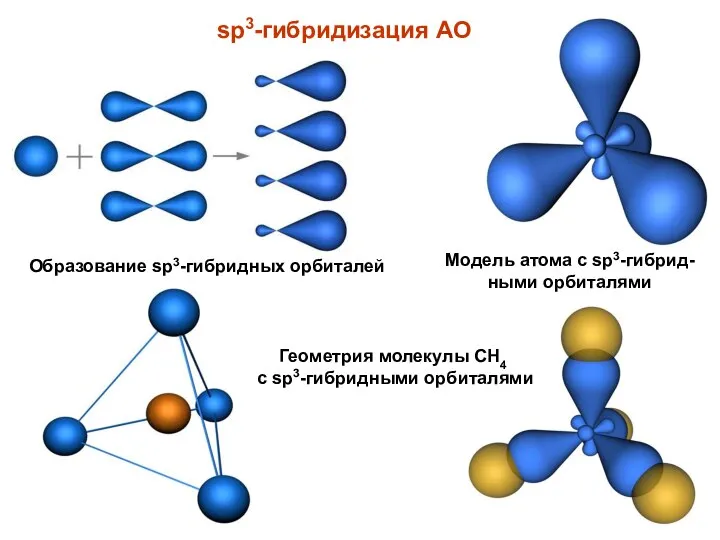
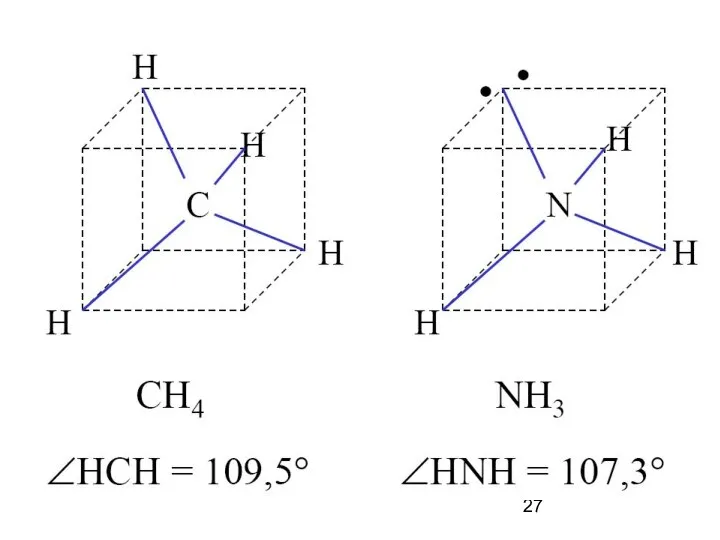
- 9. sp3-гибридизация АО Образование sp3-гибридных орбиталей Модель атома с sp3-гибрид-ными орбиталями Геометрия молекулы CH4 с sp3-гибридными орбиталями
- 10. Геометрия молекулы c sp2d-гибридными орбиталями [PdCl4]2-, [Pt(NH3)4]2+, [Ni(CN)4]2-. Геометрия молекулы с sp3d2-гибридными орбиталями SF6, PF6-, SiF62-
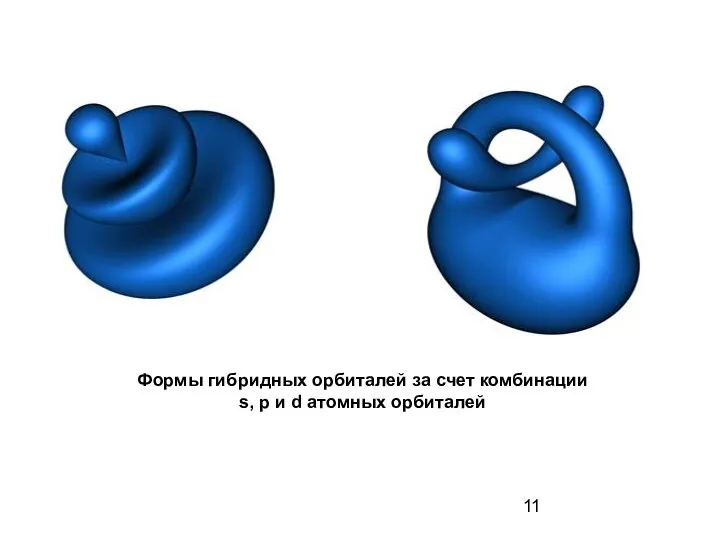
- 11. Формы гибридных орбиталей за счет комбинации s, p и d атомных орбиталей
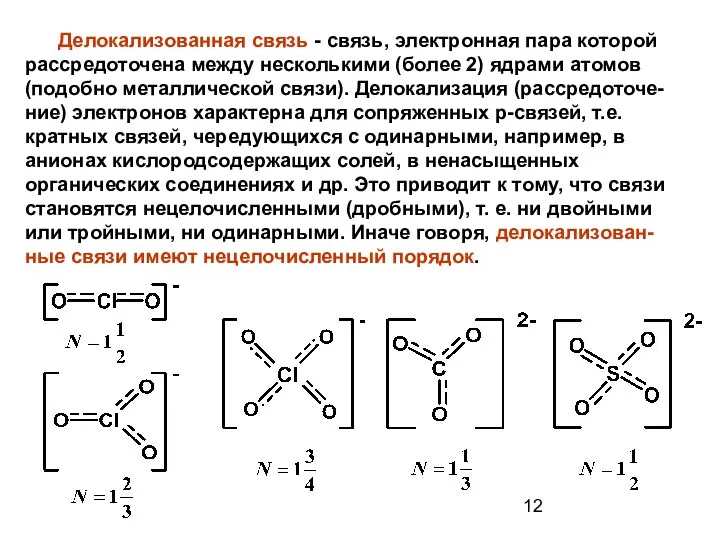
- 12. Делокализованная связь - связь, электронная пара которой рассредоточена между несколькими (более 2) ядрами атомов (подобно металлической
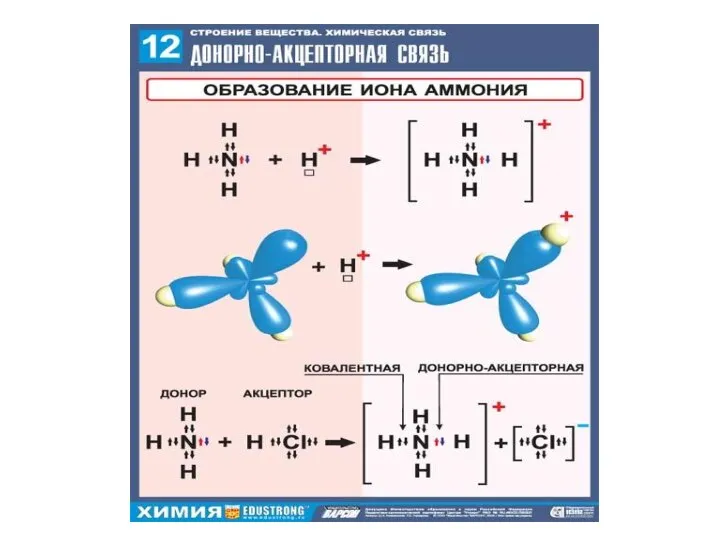
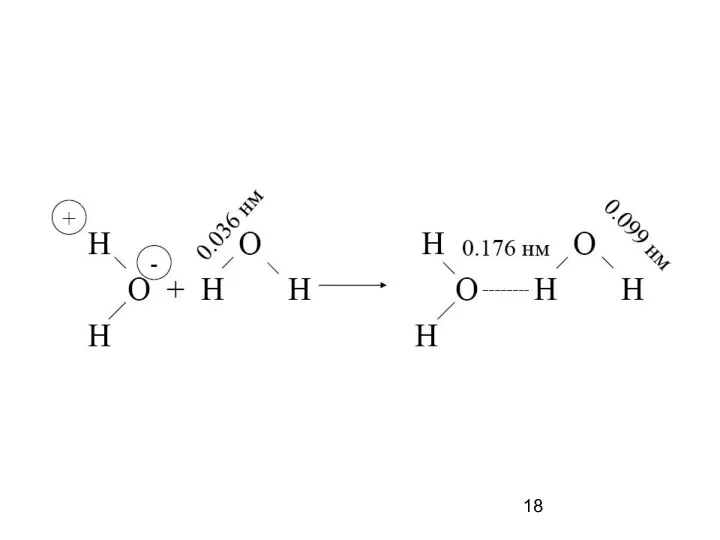
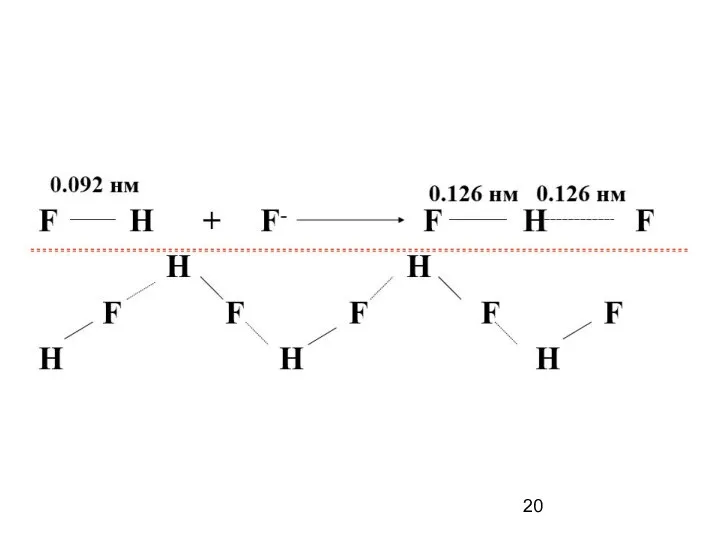
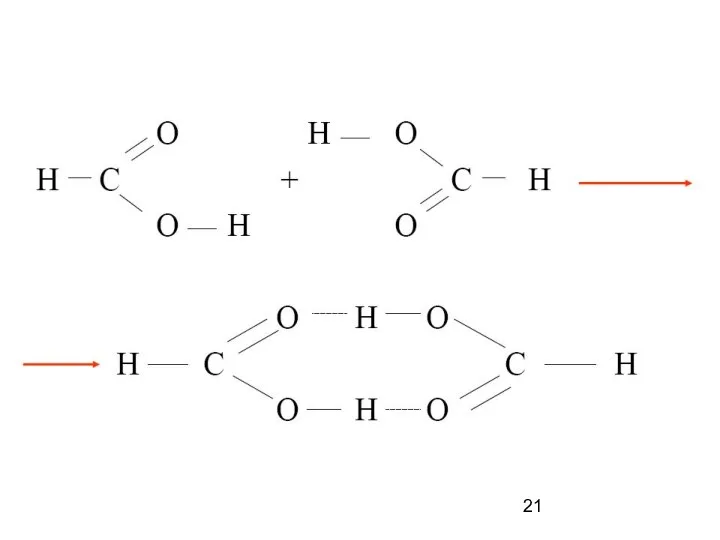
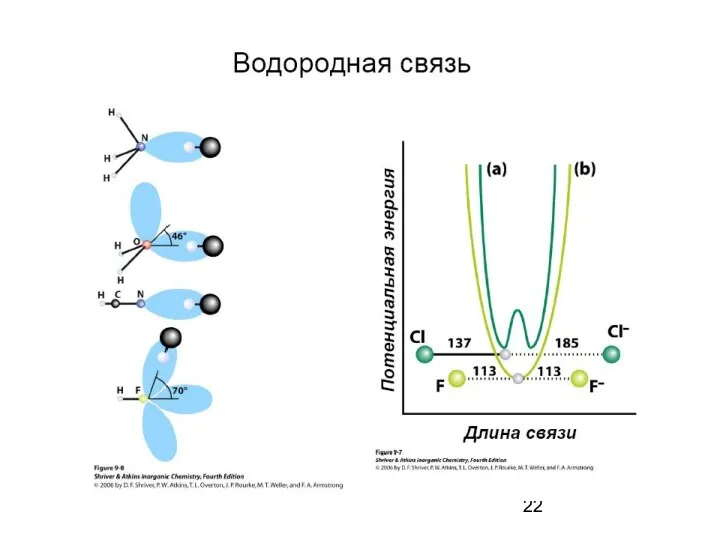
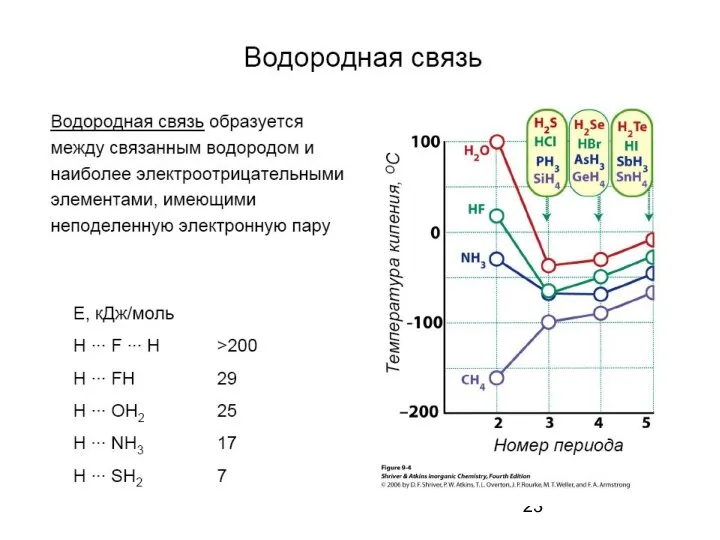
- 17. Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H, ковалентно связанным с атомом
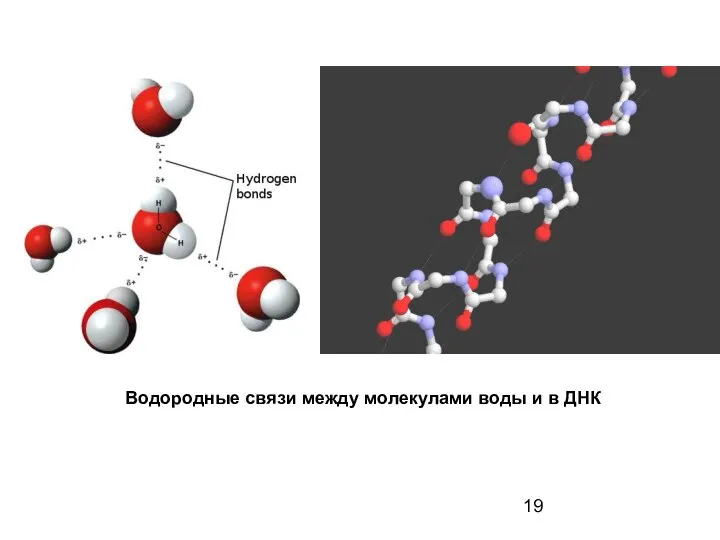
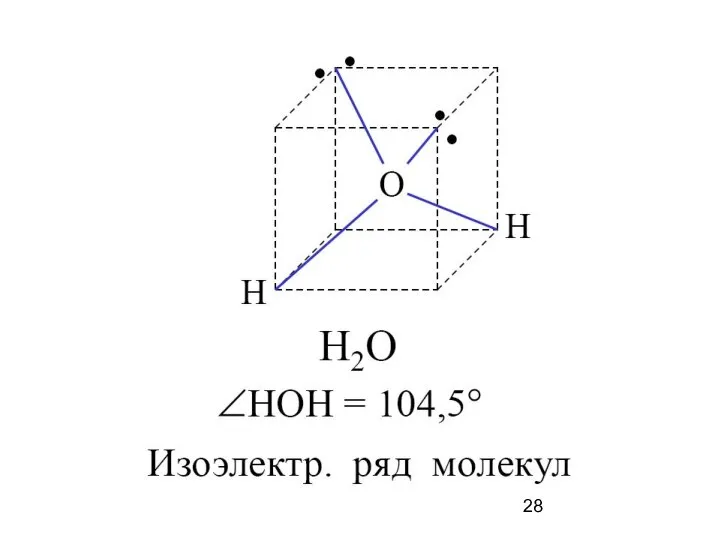
- 19. Водородные связи между молекулами воды и в ДНК
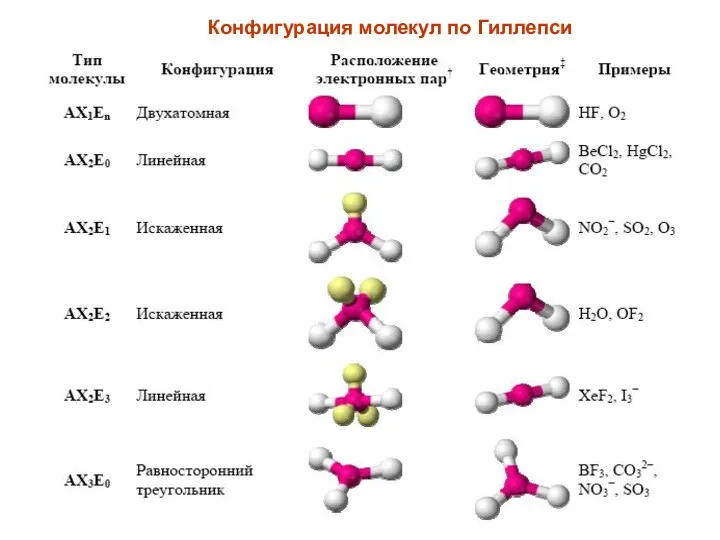
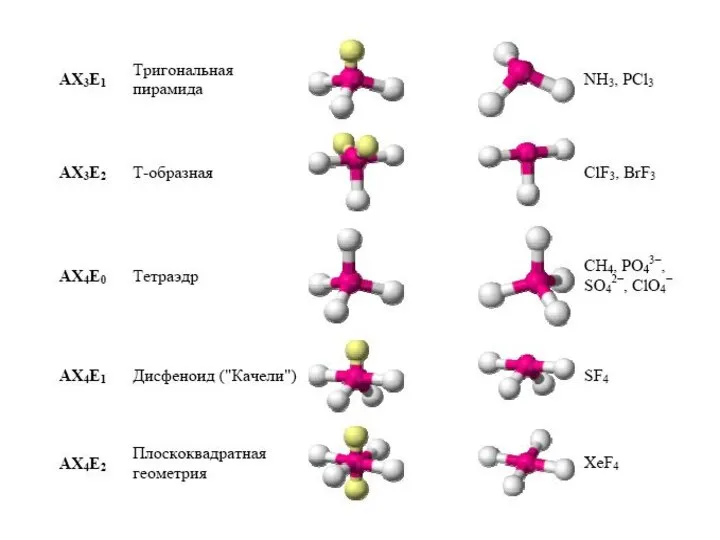
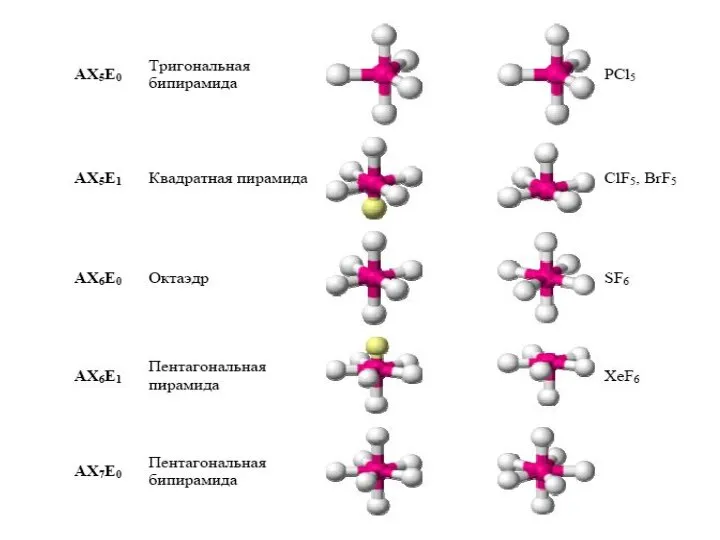
- 29. Конфигурация молекул по Гиллепси
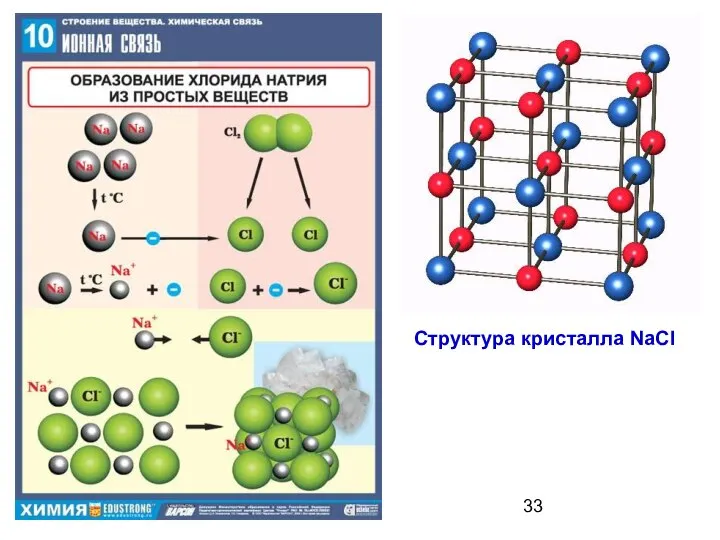
- 33. Структура кристалла NaCl
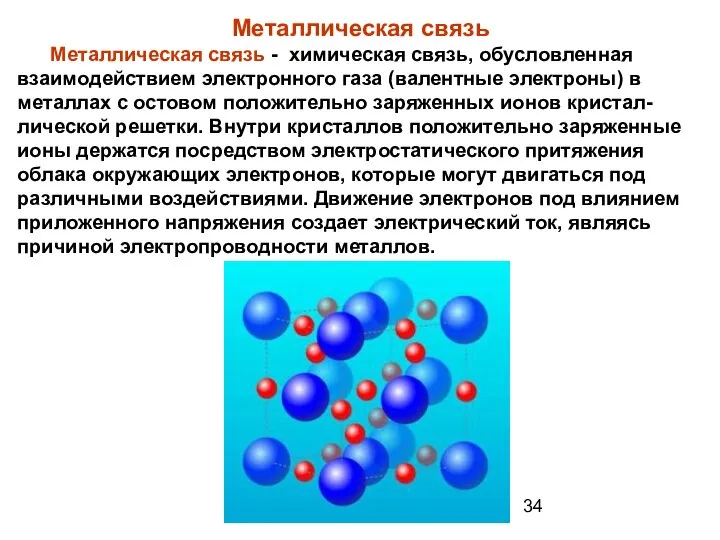
- 34. Металлическая связь Металлическая связь - химическая связь, обусловленная взаимодействием электронного газа (валентные электроны) в металлах с
- 37. Ориентационное взаимодействие Полярные молекулы, в которых центры тяжести положитель-ного и отрицательного зарядов не совпадают, например HCl,
- 38. Индукционное взаимодействие Если полярная молекула окажется рядом с неполярными, она начнет влиять на них. Поляризация нейтральной
- 39. Дисперсионное взаимодействие Между неполярными молекулами также может возникнуть притяжение. Электроны, которые находятся в постоянном движении, на
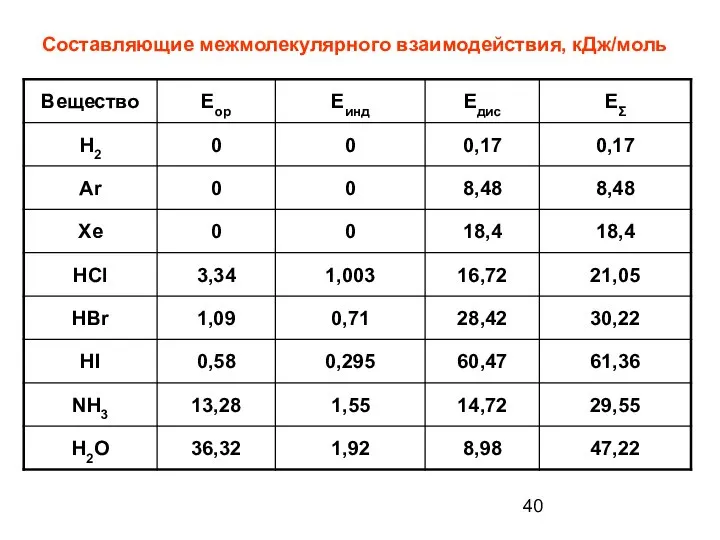
- 40. Составляющие межмолекулярного взаимодействия, кДж/моль
- 41. Межмолекулярное отталкивание Если бы молекулы только притягивались друг к другу, это привело бы к их слиянию.
- 44. Скачать презентацию



![Геометрия молекулы c sp2d-гибридными орбиталями [PdCl4]2-, [Pt(NH3)4]2+, [Ni(CN)4]2-. Геометрия молекулы с sp3d2-гибридными орбиталями SF6, PF6-, SiF62-](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/963142/slide-9.jpg)














 Презентация на тему Химическое равновесие
Презентация на тему Химическое равновесие  Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева
Презентация на тему Неорганические соединения. Периодическая таблица Д.И.Менделеева  Сұрақтар
Сұрақтар Теория электролитической диссоциации. Ионные уравнения. Задания
Теория электролитической диссоциации. Ионные уравнения. Задания Органическая химия
Органическая химия Знаки химических элементов
Знаки химических элементов Подготовка к ЕГЭ по химии
Подготовка к ЕГЭ по химии Строение электронных оболочек атомов
Строение электронных оболочек атомов Презентация на тему Интересные факты из жизни Д. И. Менделеева
Презентация на тему Интересные факты из жизни Д. И. Менделеева  Спирты. Строение
Спирты. Строение Электрический ток в металлах
Электрический ток в металлах Галогены. Положение галогенов в ПСХЭ
Галогены. Положение галогенов в ПСХЭ Коррозия металлов. Электрохимическая коррозия
Коррозия металлов. Электрохимическая коррозия Общие представления об электрохимических технологиях
Общие представления об электрохимических технологиях Типы химических реакций. Класс оксиды
Типы химических реакций. Класс оксиды Основные понятия химии
Основные понятия химии Опыты с водой
Опыты с водой Алканы. Физические свойствава алканов
Алканы. Физические свойствава алканов Магний и его сплавы
Магний и его сплавы Валентность химических элементов
Валентность химических элементов Чистячі засоби для ванної кімнати та кафелю
Чистячі засоби для ванної кімнати та кафелю Презентация на тему Строение атомного ядра
Презентация на тему Строение атомного ядра  Атомның электрондық құрылысы
Атомның электрондық құрылысы Химия в моей специальности
Химия в моей специальности Химическая кинетика. Основные понятия. Основы формальной кинетики
Химическая кинетика. Основные понятия. Основы формальной кинетики Презентация на тему Реакции соединения (8 класс)
Презентация на тему Реакции соединения (8 класс)  Glin
Glin Классификация силикатов
Классификация силикатов