Содержание
- 2. Суть Реальная геометрия молекулы определяется числом двухэлектронных двухцентровых связей (связывающих электронных пар) и наличием неподеленных электронных
- 4. Пример: определить форму молекулы Н2О Сначала определяем число электронов вокруг центрального атома. У кислорода 6 своих
- 5. Пример: определить форму молекулы SF4 Сначала определяем число электронов вокруг центрального атома. У серы 6 своих
- 7. Скачать презентацию
Слайд 2Суть
Реальная геометрия молекулы определяется числом двухэлектронных двухцентровых связей (связывающих электронных пар) и
Суть
Реальная геометрия молекулы определяется числом двухэлектронных двухцентровых связей (связывающих электронных пар) и

наличием неподеленных электронных пар (Е). При этом каждая молекула представляет собой геометрическую фигуру, вписанную в сферу. Молекула будет иметь минимум энергии, если все связывающие электронные пары будут равноудалены друг от друга на поверхности сферы. Неподеленная электронная пара занимает на сфере большую площадь, что приводит к уменьшению валентного угла тем больше, чем больше в молекуле неподеленных электронных пар E
Слайд 4Пример: определить форму молекулы Н2О
Сначала определяем число электронов вокруг центрального атома. У
Пример: определить форму молекулы Н2О
Сначала определяем число электронов вокруг центрального атома. У

кислорода 6 своих электронов, еще 2 предоставляют ему 2 атома водорода. Всего вокруг кислорода 8 электронов или 4 электронные пары. Эти пары расположены в пространстве максимально симметрично – считаем, что все они одновременно притягиваются к общему центру (кислород) и взаимно отталкиваются. Фигура, которую могут по таким законам образовать 4 шара – тетраэдр . На двух вершинах этого тетраэдра находятся ядра водорода, и между этими двумя вершинами угол может отличаться от тетраэдрического. Вывод: форма молекулы Н2 О угловая , атомы водорода на концах угла.
Слайд 5Пример: определить форму молекулы SF4
Сначала определяем число электронов вокруг центрального атома. У
Пример: определить форму молекулы SF4
Сначала определяем число электронов вокруг центрального атома. У

серы 6 своих электронов, на образование связей с 4 атомами фтора фтор “предоставляет” еще 4 электрона для получения электронных пар. Всего вокруг центрального атома серы 10 электронов или 5 пар. Максимально симметричная фигура – тригональная бипирамида (два тетраэдра с общей гранью). Фторы располагаются у двух вершин центрального треугольнаки и на противостоящих вершинах “состыкованных” пирамид. Форма молекулы SF4 – “качели”, “ручной пулемет на ножках” или дисфеноид .
- Предыдущая
Дидактические основы обучения (Лекция № 4)Следующая -
Группы и категории инвалидности
 Пропитка рубинов и сапфиров
Пропитка рубинов и сапфиров Занимательная химия в 8 классе
Занимательная химия в 8 классе карбоновые кислоты
карбоновые кислоты Химическая связь в молекулах. Экзаменационные вопросы
Химическая связь в молекулах. Экзаменационные вопросы Железо и его соединения
Железо и его соединения Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции
Реакционная система. Схема химической реакции. Закон сохранения массы веществ в химической реакции Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Презентация на тему Радиация и её воздействие на человека
Презентация на тему Радиация и её воздействие на человека  Непредельные углеводороды
Непредельные углеводороды Алкины: получение и применение
Алкины: получение и применение Применение брома
Применение брома Строение атома углерода. 10 класс
Строение атома углерода. 10 класс Минералы
Минералы Тема урока: «Свойства тканей из химических волокон»
Тема урока: «Свойства тканей из химических волокон» Химия элементов IVA группы
Химия элементов IVA группы 10 класс природные источники углеводородов
10 класс природные источники углеводородов Своя игра. Химические элементы
Своя игра. Химические элементы Материаловедение. Адсорбционные материалы. Металлоорганические каркасы
Материаловедение. Адсорбционные материалы. Металлоорганические каркасы Исследование молока
Исследование молока Основные классы неорганических соединений. Гидроксиды
Основные классы неорганических соединений. Гидроксиды Презентация на тему Физические и химические явления
Презентация на тему Физические и химические явления  Окислительно-восстановительные реакции (ОВР)
Окислительно-восстановительные реакции (ОВР) romanchuk
romanchuk Кислоты. К уроку по химии для 8 класса
Кислоты. К уроку по химии для 8 класса кулонометрия Дастан
кулонометрия Дастан Развитие творческих способностей школьников на уроках химии
Развитие творческих способностей школьников на уроках химии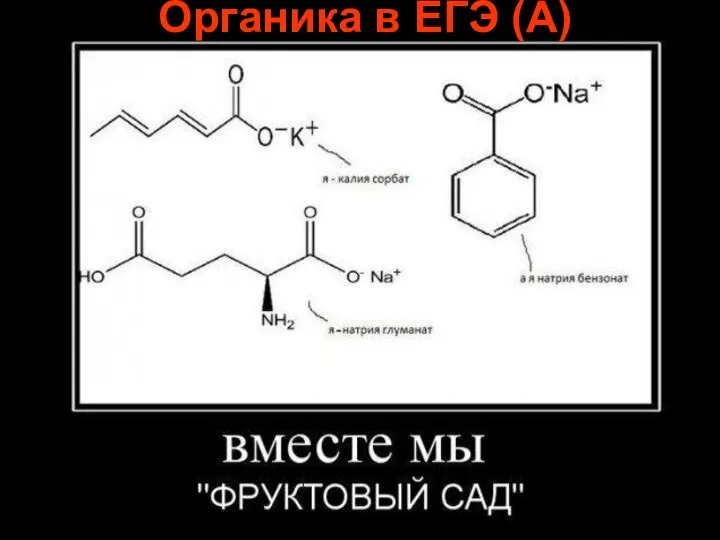 Органика в ЕГЭ (А)
Органика в ЕГЭ (А) Презентация на тему Скорость химических реакций
Презентация на тему Скорость химических реакций