Содержание
- 2. Литература Глинка Н.Л. Общая химия. – М.: Интеграл – Пресс, 2000. – 728 с. Ахметов Н.С.
- 3. "Химики, по-моему, страдают особой формой "шизофрении". В самом деле, их мышление – это причудливая смесь самых
- 4. “Кажется, говорил нам красноречивый и умный профессор Соловьев, произнося введение в химию, мы для того и
- 5. Химия - это естественная наука, изучающая окружающий нас мир со всем богатством его форм и многообразием
- 6. Химия – наука о превращениях веществ, связанных с изменением электронного окружения атомных ядер.
- 7. Наука? Вещество?
- 8. Наука - сфера человеческой деятельности, функцией которой является выработка и теоретическая схематизация объективных знаний о действительности;
- 9. Вещество – вид материи, которая обладает массой покоя. Состоит из элементарных частиц: электронов, протонов, нейтронов и
- 10. Вся природа, весь мир объективно существуют вне и независимо от сознания человека. Мир материален; все существующее
- 11. Titus Lucretius Carus, ок. 97-55 гг. до н.э. «Если бы материя не была вечной, давно бы
- 12. Что же такое материя? Материя есть объективная реальность, существующая независимо от нас (философское определение). Материя –
- 13. Д/з Эссе «Химическая эволюция материи» «Возникновение химических элементов» «Возникновение и развитие химии» «Основные парадоксы существования планеты
- 14. «Можно думать, что все явления, замеченные нами, суть разные формы движения. Механическое движение, например, движение частей
- 16. Опыт 1. Нагревание парафина
- 17. Опыт 2. Нагревание йода
- 18. Опыт 3. Нагревание медной пластинки
- 19. Опыт 4. Нагревание сахара
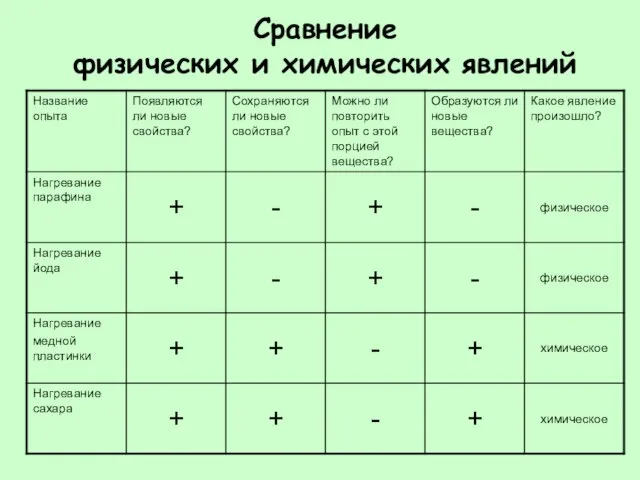
- 20. Сравнение физических и химических явлений
- 21. Общее: И при физических и при химических явлениях у веществ появляются новые свойства. Отличие: При физических
- 22. Признаки химических реакций 1. Появление окраски FeCl3 + KCNS → Fe(CNS)3 + KCl раствор кроваво-красного цвета
- 23. 2. Исчезновение окраски KMnO4 + H2SO4 + Na2SO3 → раствор темно-фиолетового цвета MnSO4 + K2SO4 +
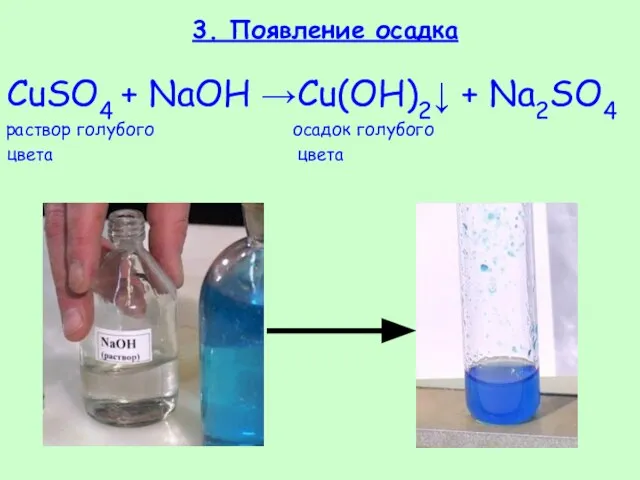
- 24. 3. Появление осадка CuSO4 + NaOH →Cu(OH)2↓ + Na2SO4 раствор голубого осадок голубого цвета цвета
- 25. 4. Исчезновение осадка Fe(OH)3↓ + HCl → FeCl3 + H2O осадок бурого цвета раствор бурого цвета
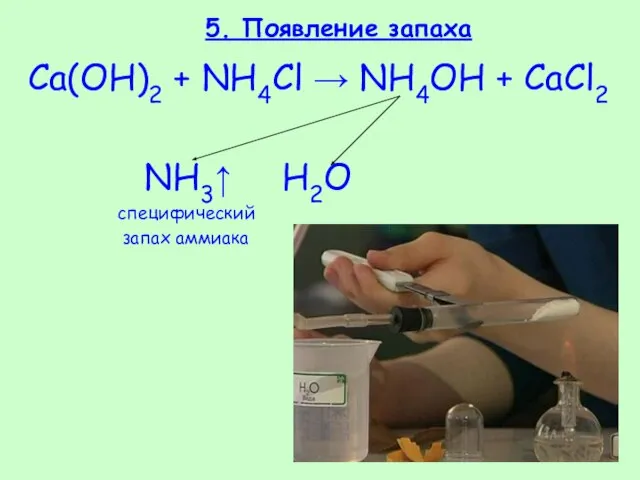
- 26. 5. Появление запаха Ca(OH)2 + NH4Cl → NH4OH + CaCl2 NH3↑ H2O специфический запах аммиака
- 27. 6. Исчезновение запаха NH4OH + HCl → NH4Cl + H2O запах аммиака («Дым без огня» –
- 28. 7. Выделение тепла NaOH + HCl → NaCl + H2O + Q
- 29. 8. Поглощение тепла N2 + O2 → NO - Q
- 30. 9. Выделение газа Na2CO3 + HCl → NaCl + CO2↑ + H2O
- 31. 10. Свечение P + O2 → P2O5 + Q белый фосфор
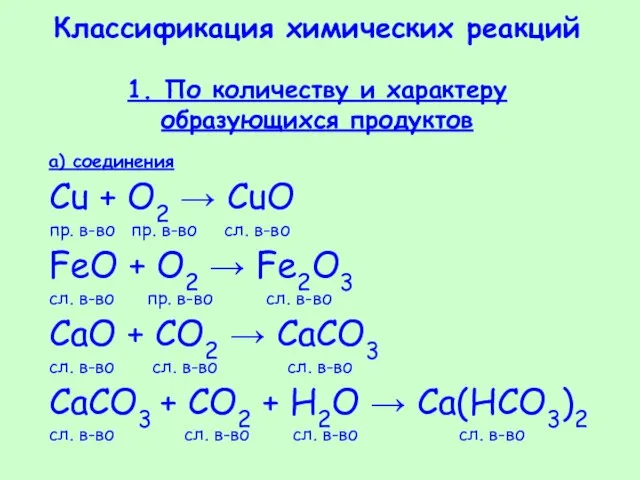
- 32. Классификация химических реакций 1. По количеству и характеру образующихся продуктов а) соединения Cu + O2 →
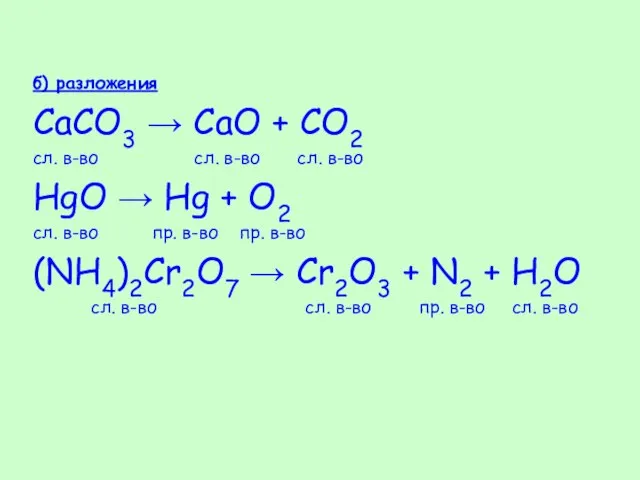
- 33. б) разложения CaCO3 → CaO + CO2 сл. в-во сл. в-во сл. в-во HgO → Hg
- 34. в) замещения Zn +CuSO4 → ZnSO4 + Cu пр. в-во сл. в-во сл. в-во пр. в-во
- 35. 2. По тепловому эффекту а) экзотермические (реакции, сопровождающиеся выделением тепла) C + O2 → CO2 +
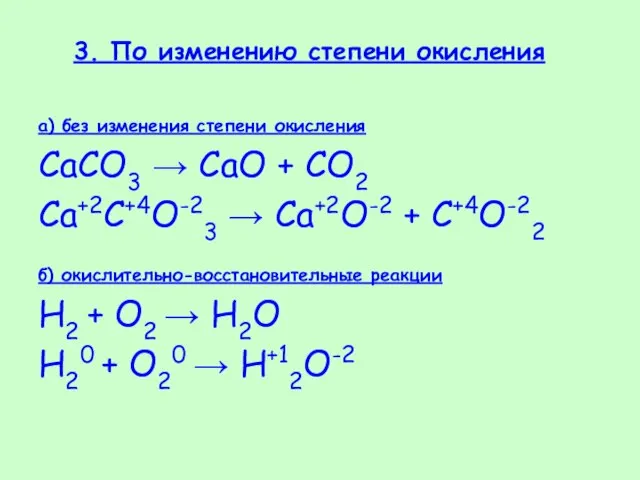
- 36. 3. По изменению степени окисления а) без изменения степени окисления CaCO3 → CaO + CO2 Ca+2C+4O-23
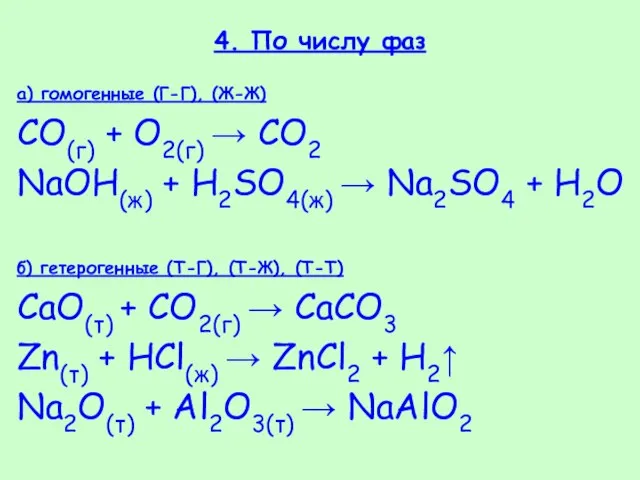
- 37. 4. По числу фаз а) гомогенные (Г-Г), (Ж-Ж) СO(г) + O2(г) → СО2 NaOH(ж) + H2SO4(ж)
- 38. 5. По обратимости а) обратимые N2 + 3H2 ⇔ 2NH3 б) необратимые Cu + HNO3 →
- 39. 6. По характеру реагирующих частиц а) ионные H+ + OH- → H2O б) атомно-молекулярные Cr2O3 +Al
- 40. 7. По влиянию на процесс а) каталитические (под действием катализатора) SO2 + O2 → SO3 катализатор
- 41. Химическая реакция – это процесс в результате которого изменяется состав, структура или заряд участвующих в процессе
- 44. Скачать презентацию

































 Свойства металлов, способы получения, их нахождение в природе, основные областях применения
Свойства металлов, способы получения, их нахождение в природе, основные областях применения Химия в быту
Химия в быту Химические свойства металлов
Химические свойства металлов pervonachalnye_svedenia_ob_org_v-kh
pervonachalnye_svedenia_ob_org_v-kh Презентация на тему Натуральные волокна
Презентация на тему Натуральные волокна  Известняк. Разновидности известняка. Области применения
Известняк. Разновидности известняка. Области применения Клеящие материалы
Клеящие материалы Классификация органических соединений
Классификация органических соединений Презентация на тему Химия моя профессия
Презентация на тему Химия моя профессия  Инертные газы
Инертные газы Аллотропия
Аллотропия Синтетические моющие средства
Синтетические моющие средства Практическое занятие: Решение задач. Классификация химических реакций
Практическое занятие: Решение задач. Классификация химических реакций Химия цвета
Химия цвета Презентация на тему Угарный газ
Презентация на тему Угарный газ  Кислородсодержащие органические соединения
Кислородсодержащие органические соединения Металлы 1 А - группы. Щелочные металлы
Металлы 1 А - группы. Щелочные металлы Углеродистые конструкционные стали
Углеродистые конструкционные стали Капиллярное поднятие жидкости
Капиллярное поднятие жидкости Оксиды и гидроксиды
Оксиды и гидроксиды Химически опасные объекты Аварии, связанные с выбросом АХОВ
Химически опасные объекты Аварии, связанные с выбросом АХОВ Физико-химия поверхностных явлений в функционировании живых систем
Физико-химия поверхностных явлений в функционировании живых систем Классификация веществ. Кислоты. Основания. Соли
Классификация веществ. Кислоты. Основания. Соли Химическая промышленность. 9 класс
Химическая промышленность. 9 класс Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия
Теория строения вещества. Межмолекулярные взаимодействия. Водородная связь. Специфические взаимодействия Фтор. Биологическое значение, соединения и применение
Фтор. Биологическое значение, соединения и применение Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат
Технология производства органических лекарственных веществ. Препараты алифатического ряда: хлороформ, йодоформ, хлоральгидрат Щелочные металлы
Щелочные металлы