Содержание
- 2. 1. Распространенность в природе Водородная туманность «Сердце»
- 3. 2. Историческая справка 1766 г. – водород открыл Г. Кавендиш 1784 г. – А. Лавуазье назвал
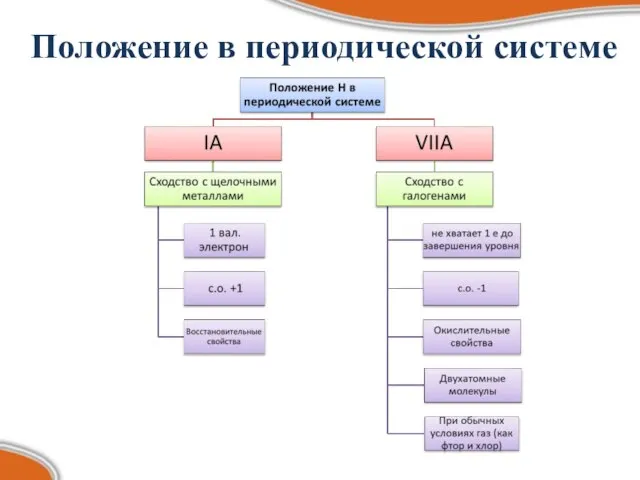
- 4. Положение в периодической системе
- 5. 3. Характеристика элемента Элемент: Порядковый №: № периода: № группы, подгруппа: Ar: p+ = ; e-
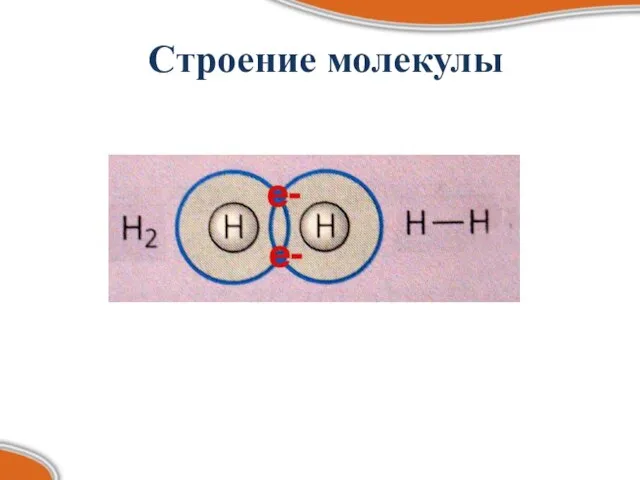
- 6. Строение молекулы
- 7. 4. Физические свойства Газ без цвета, вкуса и запаха. Легче воздуха в 14,5 раз. Плохо растворим
- 8. 5. Получение В промышленности – конверсией водяных паров с углем или метаном: С + H2O =
- 9. II. В лаборатории: 1) действием разбавленных кислот (кроме HNO3) на металлы: Zn + HCl = 2)
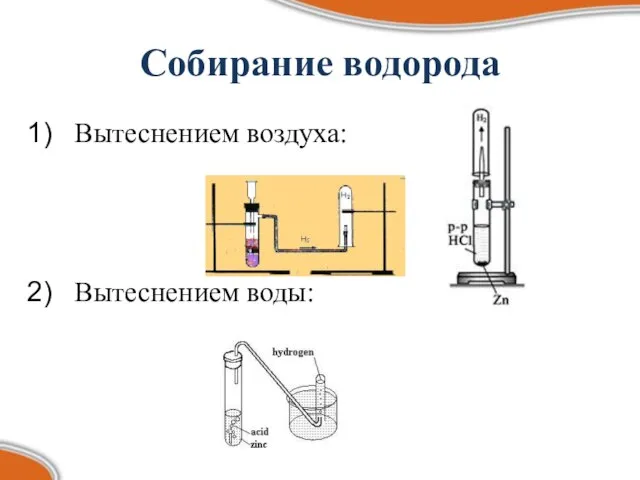
- 10. Собирание водорода Вытеснением воздуха: Вытеснением воды:
- 11. 6. Химические свойства Взаимодействие с металлами: Ca + H2 = CaH2 2) Взаимодействие с неметаллами H2
- 12. 7. Применение 1) Химическая промышленность: получение аммиака, метанола, мыла, пластмасс и др.
- 13. 2) Пищевая промышленность: а) производство маргарина б) пищевая добавка Е949 (упаковочный газ)
- 14. 3) Топливо (ракетное, машинное)
- 15. 4) Военная промышленность (производство водородных бомб)
- 16. 5) Резка и сварка металлов Пламенем водородной горелки можно резать и сваривать металлы
- 17. Задание 1 Водород является продуктом взаимодействия: 1) Cu + HCl; 2) Zn + HCl; 3) Cu
- 18. Задание 2 Водород не реагирует с: 1) N2 2) S 3) O2 4) HCl
- 19. Задание 3 Водород реагирует: 1) только с простыми веществами; 2) с простыми и сложными веществами; 3)
- 20. Задание 4 Водород реагирует с: 1) Н2О 2) SO3 3) Cl2 4) Au ! Закончите уравнение
- 21. Задание 5 Решить цепочку превращений: H2→MgH2 → H2 → X1 → H2 → X2 → H2
- 23. Скачать презентацию

















 Применение центрифугирования
Применение центрифугирования Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Кислород
Кислород Химический элемент Li
Химический элемент Li Кислоты. Оксиды
Кислоты. Оксиды Амфотерность оксида и гидроксида алюминия
Амфотерность оксида и гидроксида алюминия Презентация на тему Неорганічні речовини живих організмів
Презентация на тему Неорганічні речовини живих організмів  Мышьяк. Висмут. Сурьма
Мышьяк. Висмут. Сурьма Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить
Соли как производные кислот и оснований. Цель урока: 1.Дать определение солей. 2. Рассмотреть состав и название солей. 3. Продолжить Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері
Аминобензой қышқылы және оның туындыларының синтезі, өндіру әдісі және физика-химиялық қасиеттері Термохимия. Термодинамические параметры
Термохимия. Термодинамические параметры Презентация на тему Озоновая дыра
Презентация на тему Озоновая дыра  СТЕПЕНЬ ОКИСЛЕНИЯ
СТЕПЕНЬ ОКИСЛЕНИЯ Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2
Характеристика химического элемента по кислотно-основным свойствам образуемых им соединений. Урок №2 Основы кристаллографии
Основы кристаллографии ZhK_Prezentatsia_1
ZhK_Prezentatsia_1 Круговорот серы в природе
Круговорот серы в природе Карбоновые кислоты
Карбоновые кислоты Аминокислоты и их применение
Аминокислоты и их применение Обмен углеводов
Обмен углеводов Химия – наука, преобразующая мир для учеников. 7-8 классов
Химия – наука, преобразующая мир для учеников. 7-8 классов Химические уравнения
Химические уравнения Взаимодействие кислот с металлами
Взаимодействие кислот с металлами Обобщение свойств углеводородов
Обобщение свойств углеводородов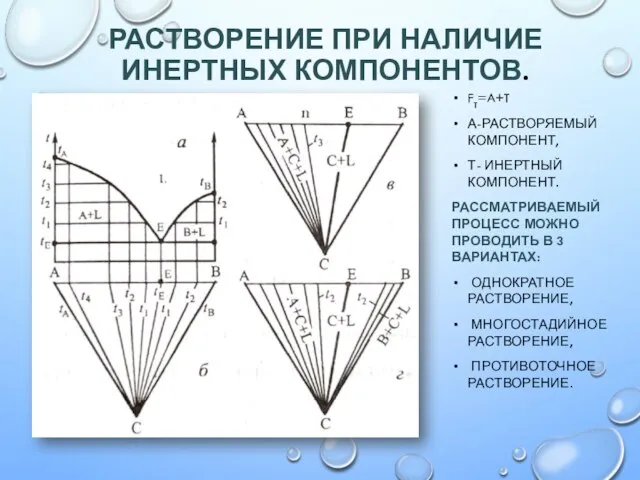 Растворение при наличии инертных компонентов
Растворение при наличии инертных компонентов Химические свойства воды
Химические свойства воды Карбоновые кислоты
Карбоновые кислоты Интерактивный плакат Алканы
Интерактивный плакат Алканы