Слайд 2Основные свойства
Чем большим радиусом атома обладает химический элемент, тем он проявляет более

сильные металлические свойства, и тем более сильными основными свойствами обладают его соединения.
Основные свойства веществ проявляются во взаимодействии их с кислотами, кислотными оксидами, амфотерными оксидами и основаниями, а также некоторыми неметаллами (в определённых условиях).
Слайд 3Li Li2O LiOH
Na Na2O NaOH
K K2O KOH
Mg MgO Mg(OH)2
Ca CaO Ca(OH)2
Cr CrO

Cr(OH)2
Основные свойства проявляют оксиды (М2О и МО) и гидроксиды металлов (МОН и М(ОН)2)в степени окисления +1 и +2 (за исключением Be и Zn)
Слайд 4Кислотные свойства
Чем меньше радиус атома химического элемента, тем он проявляет более сильные

неметаллические свойства, и тем более сильными кислотными свойствами обладают его соединения.
Кислотные свойства обратны основным
Слайд 5P P2O5 H3PO4
S SO3 H2SO4
Cl2 Cl2O7 HClO4
V V2O5 HVO3
Cr CrO3 H2CrO4
Кислотные свойства

проявляют оксиды и гидроксиды неметаллов в степени окисления ≥+3, а также оксиды и гидроксиды металлов в степени окисления ≥+5
Слайд 6Амфотерные свойства
Проявляют химические элементы, которые занимают промежуточное (граничное) положение между типичными металлами

и типичными неметаллами, амфотерны и их соединения.
Амфотерность заключается во взаимодействии данных веществ (оксидов, гидроксидов) как с сильными основаниями (основными оксидами) так и кислотами (кислотными оксидами).
Слайд 7Be BeO Be(OH)2
Zn ZnO Zn(OH)2
Al Al2O3 Al(OH)3
Fe Fe2O3 Fe(OH)3
Cr Cr2O3 Cr(OH)3
Mn MnO2

Mn(OH)4
Амфотерные свойства проявляют оксиды и гидроксиды металлов в степени окисления +3, +4, а также соединения Be и Zn.
Слайд 8Основные свойства
Na2O + 2HCl = 2NaCl + H2O
Na2O + SO2 = Na2SO3
NaOH
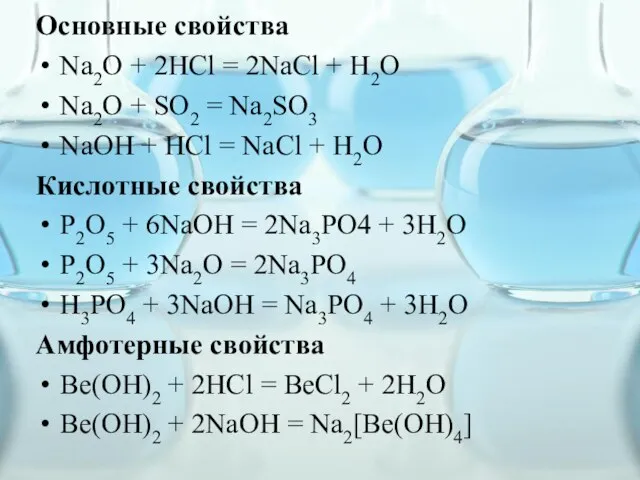
+ HCl = NaCl + H2O
Кислотные свойства
P2O5 + 6NaOH = 2Na3PO4 + 3H2O
P2O5 + 3Na2O = 2Na3PO4
H3PO4 + 3NaOH = Na3PO4 + 3H2O
Амфотерные свойства
Be(OH)2 + 2HCl = BeCl2 + 2H2O
Be(OH)2 + 2NaOH = Na2[Be(OH)4]
Слайд 9У химических элементов, которые проявляют множество степеней окисления для нижних характерны основные

свойства, для промежуточных – амфотерные, для высоких – кислотные. Например, Cr:
Слайд 10Амфотерность Zn(OH)2
Используя, выданные реактивы, получите гидроксид цинка и докажите его амфотерность путём

проведения соответствующих химических реакций.
Запишите в тетрадь уравнения проведённых химических реакций в молекулярном виде, а дома допишите их в полном и сокращённом ионном виде.









 Материаловедение. Методы исследования в материаловедении (лекция 1)
Материаловедение. Методы исследования в материаловедении (лекция 1) Альдегиды. Номенклатура, изомерия. Получение альдегидов
Альдегиды. Номенклатура, изомерия. Получение альдегидов Металлы. Кроссворд
Металлы. Кроссворд Презентация на тему Золото
Презентация на тему Золото  Понятие об ароматических спиртах и фенолах. Особенности строения фенола
Понятие об ароматических спиртах и фенолах. Особенности строения фенола Свойства неорганических веществ
Свойства неорганических веществ Окислительно-восстановительные реакции. Электролиз
Окислительно-восстановительные реакции. Электролиз Карбоновые кислоты
Карбоновые кислоты Уравнение состояния
Уравнение состояния История гипса
История гипса Cкорость химических реакций
Cкорость химических реакций Физика полимеров Ч1
Физика полимеров Ч1 Комплексные соединения
Комплексные соединения Химическая шкатулка
Химическая шкатулка Vielu īpašības
Vielu īpašības Исследование концентрированных заквасок для сметаны
Исследование концентрированных заквасок для сметаны Основы химической кинетики
Основы химической кинетики Задача 11 Ртутное сердце Команда: Мастера Беспорядка
Задача 11 Ртутное сердце Команда: Мастера Беспорядка Двовимірний ямр. Основні принципи
Двовимірний ямр. Основні принципи Карбонаты (3)
Карбонаты (3) Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Как искупаться дома в морской воде?
Как искупаться дома в морской воде? Степень окисления
Степень окисления Неметаллы
Неметаллы 20140111_mineraly
20140111_mineraly Закономерности изменения свойств галогенов
Закономерности изменения свойств галогенов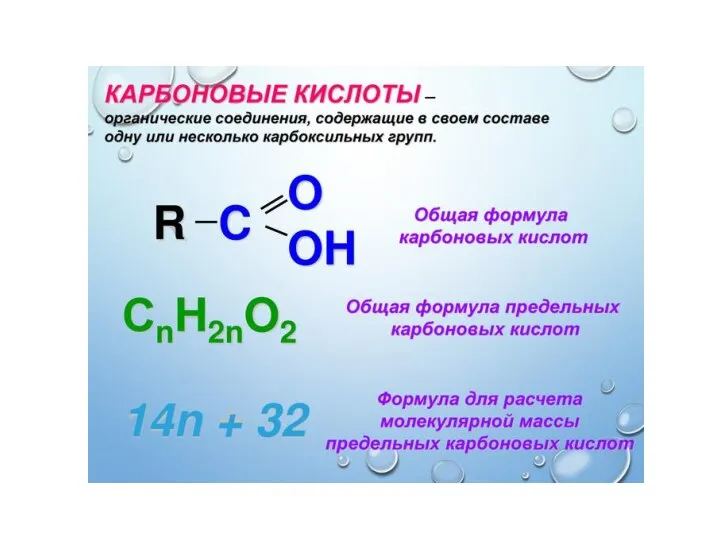 Карбоновые кислоты
Карбоновые кислоты Подгруппа кислорода. Решение экспериментальных задач
Подгруппа кислорода. Решение экспериментальных задач