Содержание
- 2. Дать понятие об амфотерности; Рассмотреть амфотерные оксид и гидроксид алюминия; Повторить, закрепить и развить знания о
- 3. ПОВТОРЕНИЕ ИЗУЧЕННОГО МАТЕРИАЛА: Применение алюминия
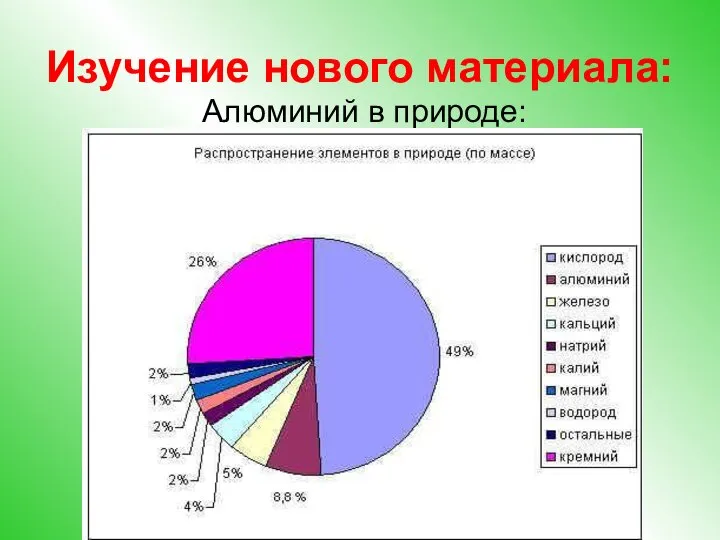
- 4. Изучение нового материала: Алюминий в природе:
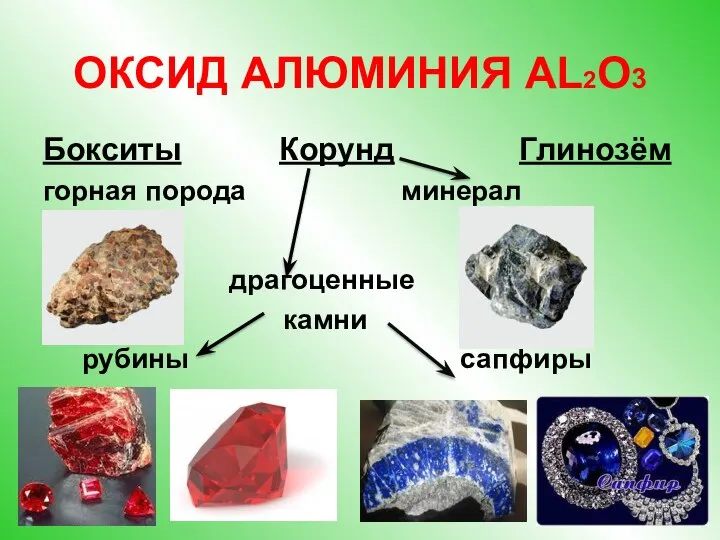
- 5. ОКСИД АЛЮМИНИЯ AL2O3 Бокситы Корунд Глинозём горная порода минерал драгоценные камни рубины сапфиры
- 6. В очищенном виде AL2O3 - белый тугоплавкий порошок, температура плавления 2044°С, температура кипения 3530°С, плотность 4
- 7. ГИДРОКСИД АЛЮМИНИЯ AL(OH)3 белое гелеобразное вещество, нерастворимое в воде, входит в состав многих бокситов. типичное амфотерное
- 8. Получение гидроксида алюминия В 2 пробирки налейте по 1 мл раствора соли алюминия В обе пробирки
- 9. Доказательство амфотерности: 1.Взаимодействие с кислотами В одну пробирку с осадком прилейте раствор соляной кислоты. 2.Взаимодействие со
- 10. Что наблюдали? Осадки гидроксида алюминия в обеих пробирках растворяются. Вывод: гидроксид алюминия проявляет свойства оснований, взаимодействуя
- 11. Al(OH)3 + 3HCl = AlCl3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] Запишите уравнения реакций:
- 12. Лабораторный опыт От перемены мест слагаемых сумма …. изменяется!!! 1. В одну пробирку налейте 1 мл
- 13. Что наблюдали? В первой пробирке образовывался осадок, а во второй НЕТ !!! Вывод: для амфотерных соединений
- 15. Скачать презентацию







![Al(OH)3 + 3HCl = AlCl3 +3H2O Al(OH)3 + NaOH = Na[Al(OH)4] Запишите уравнения реакций:](/_ipx/f_webp&q_80&fit_contain&s_1440x1080/imagesDir/jpg/1105250/slide-10.jpg)


 Алканы, алкены, алкины
Алканы, алкены, алкины Реакции окисления-восстановления в химическом анализе. (Лекция 7.2)
Реакции окисления-восстановления в химическом анализе. (Лекция 7.2) Предельные углеводороды (алканы)
Предельные углеводороды (алканы) Экологическая химия
Экологическая химия Ионные уравнения
Ионные уравнения Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение
Технология производства пленок. Свойства полимерных пленочных материалов, модификация, применение Алкадиены
Алкадиены Степень окисления
Степень окисления О чем не узнаешь на уроке
О чем не узнаешь на уроке Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини
Виготовлення водних розчинів з заданою масовою часткою розчиненої речовини История развития технологий термического крекинга в России и мире
История развития технологий термического крекинга в России и мире Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты)
Наша стирка по-байкальски. Синтетические моющие средства (СМС¸ детергенты) Презентация на тему В мире индикаторов - исследовательская работа
Презентация на тему В мире индикаторов - исследовательская работа  Реакции ионного обмена
Реакции ионного обмена Химия — это наука о веществах, их свойствах и превращениях
Химия — это наука о веществах, их свойствах и превращениях Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи
Рівновага в розчинах електролітів. Гідроліз солей. Буферні системи Соли, их классификация и свойства
Соли, их классификация и свойства Синтетические высокомолекулярные органические вещества
Синтетические высокомолекулярные органические вещества Практическая работа №5. Качественные реакции на анионы 1-3 групп
Практическая работа №5. Качественные реакции на анионы 1-3 групп Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год
Сучкова Н.В. учитель химии первой квалификационной категории 2008-2009 учебный год Определение понятия сплавов. Сплавы на основе железа и меди
Определение понятия сплавов. Сплавы на основе железа и меди Способы получения веществ 14 (IVА) группы элементов
Способы получения веществ 14 (IVА) группы элементов Ароматические углеводороды. Строение молекулы бензола. Физические свойства
Ароматические углеводороды. Строение молекулы бензола. Физические свойства Кислоты. Состав, названия и классификация
Кислоты. Состав, названия и классификация Техника безопасности на уроках химии
Техника безопасности на уроках химии Селективность (реакторы)
Селективность (реакторы) Строение и свойства алканов
Строение и свойства алканов