Содержание
- 2. Кислоты– ЭТО СЛОЖНЫЕ ВЕЩЕСТВА, СОСТОЯЩИЕ ИЗ АТОМОВ ВОДОРОДА, СПОСОБНОГО ЗАМЕЩАТЬСЯ НА АТОМЫ МЕТАЛЛОВ, И КИСЛОТНЫХ ОСТАТКОВ.
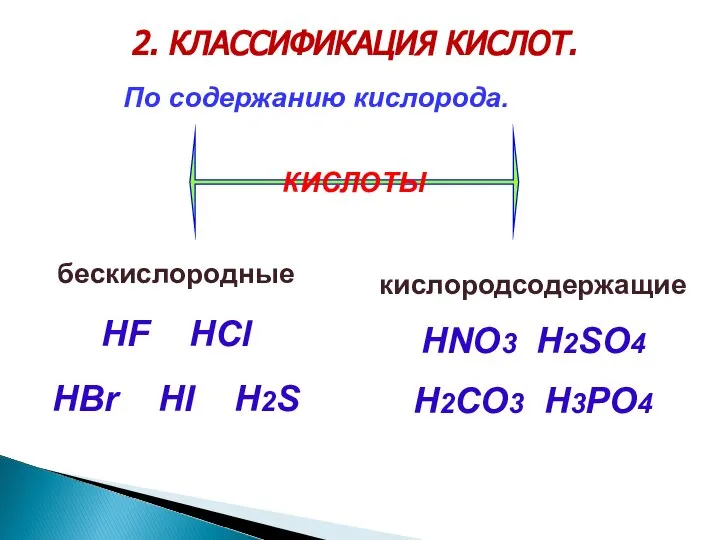
- 3. 2. КЛАССИФИКАЦИЯ КИСЛОТ. бескислородные HF HCl HBr HI H2S По содержанию кислорода. кислородсодержащие HNO3 H2SO4 H2CO3
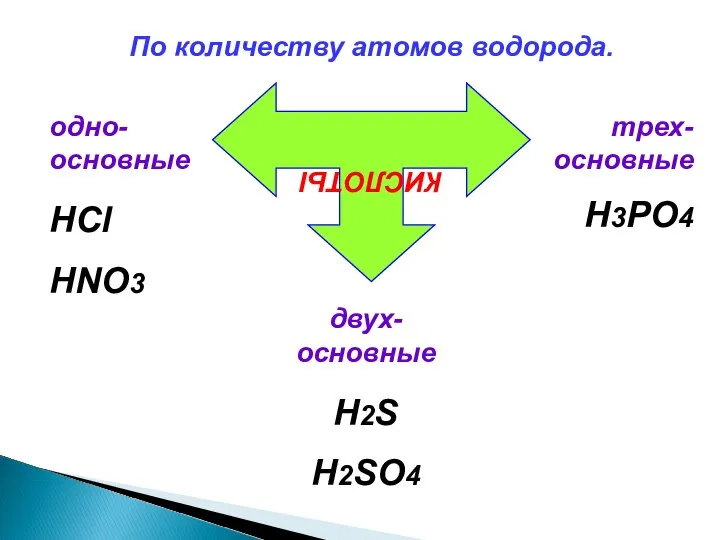
- 4. По количеству атомов водорода. КИСЛОТЫ одно-основные HCl HNO3 двух-основные H2S H2SO4 трех-основные H3PO4
- 5. НЕОРГАНИЧЕСКИЕ- СЕРНАЯ, СОЛЯНАЯ, ПЛАВИКОВАЯ, ФОСФОРНАЯ, АЗОТНАЯ.
- 6. ОРГАНИЧЕСКИЕ – ЛИМОННАЯ, ЯБЛОЧНАЯ, УКСУСНАЯ, ЩАВЕЛЕВАЯ, МУРАВЬИНАЯ.
- 7. Соляная кислота, находящаяся в желудке, помогает переваривать пищу. Молочная кислота образуется в мышцах при физической нагрузке.
- 8. Аскорбиновая, фолиевая, липоевая, ацетил- салициловая и другие
- 9. Уксусная и лимонная кислоты.
- 10. SO2+H2O=H2SO3 ОБРАЗОВАНИЕ КИСЛОТНЫХ ДОЖДЕЙ В ПРИРОДЕ.
- 11. Сила кислот уменьшается HClO4, H2SO4, HCl , H2SO3, H2СO3, H2S, H2SiO3 HNO3 H3PO4 Под силой кислоты
- 12. Сильные кислоты Слабые кислоты HI HF HBr H3PO4-средняя HCl H2SO3 H2SO4 H2S HNO3 H2CO3 H2SiO3 HNO2
- 13. 1. При разбавлении кислот с водой следует кислоту тонкой струйкой при перемешивании наливать в воду, а
- 14. Ряд активности (напряжений) металлов создан русским ученым Н.Н.Бекетовым в1865 году. /К Са Na Mg Al/ Zn
- 15. Три условия: Кислота растворимая (кроме HNO3) Ме стоит в ряду активности до водорода Получается растворимая соль
- 16. Следует помнить, что в реакциях металлов с HNO3 (конц.) и H2SO4(конц) H2 не образуется, а образуются
- 18. Скачать презентацию













 ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области
ФБОУ- Раздольненская средняя общеобразовательная школа №19 Новосибирского района Новосибирской области Техносферная безопасность. Химия как наука
Техносферная безопасность. Химия как наука Кислоты. состав, номенклатура и их их классификация
Кислоты. состав, номенклатура и их их классификация Презентация на тему Медь
Презентация на тему Медь  Металлы и их соединения
Металлы и их соединения Применение коллоидных систем
Применение коллоидных систем Презентация на тему Нефть. Свойства, состав, переработка
Презентация на тему Нефть. Свойства, состав, переработка  Физическая химия
Физическая химия Способы очистки питьевой воды
Способы очистки питьевой воды Косметические средства. Виды, состав и влияние на организм
Косметические средства. Виды, состав и влияние на организм Углерод
Углерод Презентация на тему Лекарства 10 класс
Презентация на тему Лекарства 10 класс  Вода - это жизнь
Вода - это жизнь Расчеты по химическим уравнениям реакций
Расчеты по химическим уравнениям реакций Стекло. Лекция №22
Стекло. Лекция №22 Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1
Ð¥ÐÐÐЧÐСÐÐÐ Ð ÐÐÐÐÐÐСÐÐ1 Удивительные свойства латекса и его применение
Удивительные свойства латекса и его применение Презентация на тему Фосфор 9 класс
Презентация на тему Фосфор 9 класс  Окислительно-восстановительные реакции
Окислительно-восстановительные реакции Ароматические углеводороды. Галогенопроизводные
Ароматические углеводороды. Галогенопроизводные Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза
Относительный вклад % буферных систем крови в поддержание в ней протолитического гомеостаза Селективное каталитическое восстановление оксидов азота
Селективное каталитическое восстановление оксидов азота Отчет по ПП 03.01. Лаборант химического анализа
Отчет по ПП 03.01. Лаборант химического анализа Химические связи и взаимное влияние атомов в органических соединениях
Химические связи и взаимное влияние атомов в органических соединениях Вода знакомая и не знакомая
Вода знакомая и не знакомая Синтетические высокомолекулярные органические вещества
Синтетические высокомолекулярные органические вещества Массовые доли веществ задачи
Массовые доли веществ задачи Первоначальные сведения о строении вещества
Первоначальные сведения о строении вещества