Слайд 2Определение
Реакции ионного обмена – это реакции между сложными веществами в растворах, в

результате которых реагирующие вещества обмениваются своими составными частями.
Так как в этих реакциях происходит обмен ионами – они называются ионными.
Протекают без изменений степеней окисления.
Слайд 3Правило Бертолле:
Реакции обмена в растворах электролитов протекают до конца (возможны) только

тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит.
Слайд 4Например:
Нитрат серебра взаимодействует с бромидом калия
AgNО3 + КВr = АgВr↓ + КNО3
Хлорид железа

взаимодействует с гидроксидом натрия
FeCl3+3NaOH→3NaCl+Fe(OH)3↓
Гидроксид железа взаимодействует с соляной кислотой 2Fe(OH)3+6HCl→2FeCl3+6H2O
Слайд 5
Правила составления уравнений реакций ионного обмена.
1. Записываем молекулярное уравнение реакции, не забывая

расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
Слайд 6 3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые

электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na+ + 3Cl—
Слайд 7 4. Находим одинаковые ионы (они не приняли участия в реакции в левой

и правой частях уравнения реакции) и сокращаем их слева и справа.
3Na+ + 3OH— + Fe3+ + 3Cl— = Fe(OH)3 + 3Na+ + 3Cl—
Слайд 85. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли

участие в реакции).
Fe3+ + 3OH— = Fe(OH)3
Слайд 9На ионы мы не разбиваем:
Оксиды; осадки; газы; воду; слабые электролиты (кислоты и

основания)
Анионы кислотных остатков кислых солей слабых кислот (НСО3—, Н2РО4— и т.п.) и катионы основных солей слабых оснований Al(OH)2+
Комплексные катионы и анионы: [Al(OH)4]—
Слайд 10Например, взаимодействие сульфида цинка и серной кислоты
н р р р
ZnS + H2SO4 =

ZnSO4 + H2S
ZnS + 2H+ + SO42— = Zn2+ + SO42— + H2S
ZnS + 2H+ = Zn2+ + H2S
Слайд 11Например, взаимодействие гидрокарбоната натрия и гидроксида натрия
р р р
NaHCO3 + NaOH =

Na2CO3 + H2O
Na+ + НСО3— + Na+ + ОН— = 2Na+ + CO32- + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются.
НСО3—+ ОН— = CO32- + H2O










 Алкадиены. Закрепление пройденного материала
Алкадиены. Закрепление пройденного материала Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна
Распределение полициклических ароматических углеводородов в углях Кузнецкого угольного бассейна Силумины. Виды силуминов
Силумины. Виды силуминов Рідкі кристали
Рідкі кристали Кислород
Кислород Скорость химических реакций
Скорость химических реакций Состояния вещества. Тест. 5 класс
Состояния вещества. Тест. 5 класс Горные породы
Горные породы Химическая связь
Химическая связь Вычисление массовой доли элемента в молекуле
Вычисление массовой доли элемента в молекуле Презентация на тему Применение жиров
Презентация на тему Применение жиров  Открытие Менделеева Д. И
Открытие Менделеева Д. И Металлы и их соединения
Металлы и их соединения Серная кислота и её соли. Качественная реакция на сульфат-ион
Серная кислота и её соли. Качественная реакция на сульфат-ион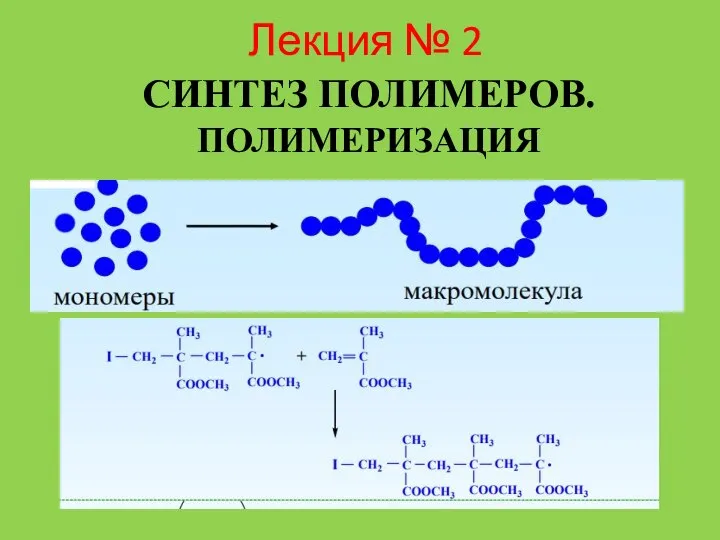 Лекция № 2. Синтез полимеров. Полимеризация
Лекция № 2. Синтез полимеров. Полимеризация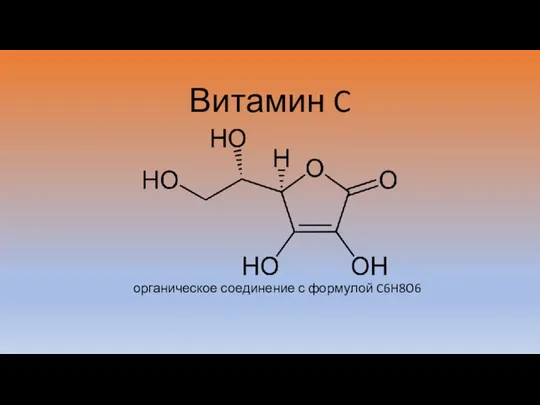 Витамин C
Витамин C Презентация на тему Азотная кислота и ее соли (9 класс)
Презентация на тему Азотная кислота и ее соли (9 класс)  Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования:
Леция 1. Природа сил взаимодействия. Методы исследования комплексообразования: Растворы. Процесс растворения (2)
Растворы. Процесс растворения (2) Химические формулы. Относительная молекулярная масса. 8 класс
Химические формулы. Относительная молекулярная масса. 8 класс Металлы. Общая характеристика ( 9 класс)
Металлы. Общая характеристика ( 9 класс) Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс
Тестовая работа по теме: Реакции ионного обмена. Химия. 9 класс Получение и примененипе радиоактивные изотопы
Получение и примененипе радиоактивные изотопы Цикл Кребса
Цикл Кребса Михаил Васильевич Ломоносов (1711-1765)
Михаил Васильевич Ломоносов (1711-1765) Общие способы получения металлов
Общие способы получения металлов Особенности органических веществ
Особенности органических веществ Химический состав клетки
Химический состав клетки