Слайд 2Нуклеиновые кислоты (НК) – природные биополимеры нуклеотидов, построенные из нуклеотидов, связанных 3',5'-фосфодиэфирными

связями. Вещества наследственности. Высокомолекулярные (мол. масса от 5 тыс. до 10 млн.) твердые вещества кислотной природы, умеренно и плохо растворимые в воде, растворимы в щелочах, нерастворимы в органических растворителях.
По составу, строению и функциям НК делятся на 2 класса:
ДНК – дезоксирибонуклеиновые кислоты, построены из дезоксирибонуклеотидов – сохраняют наследственную (генетическую) информацию.
РНК - рибонуклеиновые кислоты, построены из рибонуклеотидов – участвуют в сохранении и использовании генетической информации.
Слайд 3Все НК in vivo связаны с белками:
ДНК кодируют и сохраняют генетическую

информацию в клеточных ядрах (ядерная ДНК) и в матриксе митохондрий (митохондриальная ДНК), образуют нуклеопротеидные комплексы.
РНК содержатся в ядрах и митохондриях, рибосомах и цитозоле, делятся на:
Информационные (матричные) РНК – кратковременно сохраняют генетическую информацию
Транспортные РНК – транспортируют аминокислоты к рибосомам
Рибосомальные РНК – входят в состав рибосом
Слайд 4Гидролиз нуклеопротеинов.
Протекает ступенчато: нуклеопротеины в кислой (или нейтральной in vivo) до

НК, НК в щелочной среде до нуклеотидов, а затем до нуклеозидов, а нуклеозиды – в кислой среде до азотистых оснований и пентоз ((2-дезокси)-D-рибозы)):
Нуклеопротеин + Н2О/Н+ → НК + белок
НК + Н2О/OH- → нуклеотиды → нуклеозиды + фосфаты
Нуклеозиды + Н2О/H+ → азотистые основания + пентоза
Слайд 5Азотистые основания нуклеиновых кислот.
Азотистые основания – гетероциклические ароматические соединения – бесцветные

кристаллические высокоплавкие вещества, термически и термодинамически устойчивые, плохо растворимые в воде (лучше – в горячей) и органических растворителях, слабые основания.
Классифицируются на: пиримидиновые (тимин (Т), цитозин (Ц), урацил (У)) и пуриновые (аденин (А), гуанин (Г)). Т содержится только в ДНК, а У – только в РНК.
В составе НК также имеются модифицированные азотистые основания.
Азотистые основания метаболизируют окислением с образованием производных – гипоксантина, ксантина и мочевой кислоты. Мочевая кислота (2,6,8-триоксопурин) – конечный продукт метаболизма пуриновых азотистых оснований.
Слайд 6Лактим-лактамная таутомерия азотистых оснований НК.
Для Т, Ц, У и Г характерна
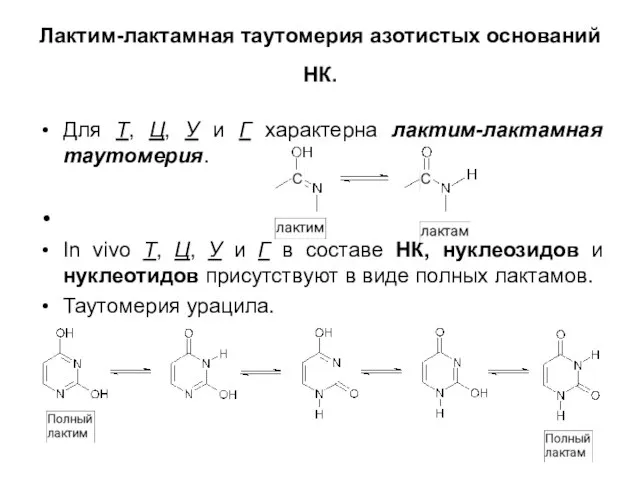
лактим-лактамная таутомерия.
In vivo Т, Ц, У и Г в составе НК, нуклеозидов и нуклеотидов присутствуют в виде полных лактамов.
Таутомерия урацила.
Слайд 7Азотистые основания нуклеиновых кислот.
В структуре природных НК А комплементарен Т (в
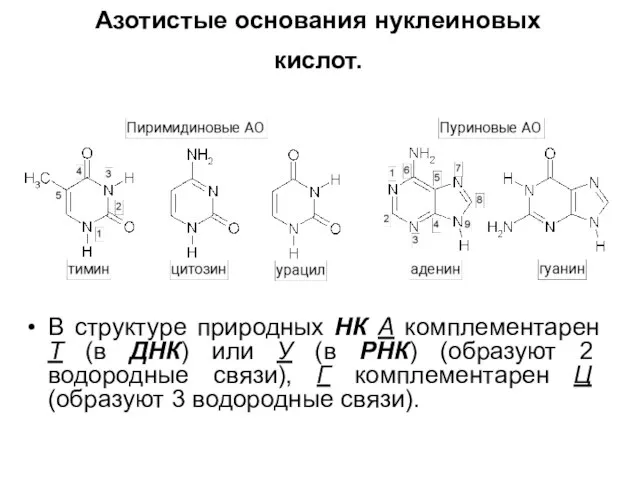
ДНК) или У (в РНК) (образуют 2 водородные связи), Г комплементарен Ц (образуют 3 водородные связи).
Слайд 8Мочевая кислота.
Бесцветное кристаллическое вещество, слабая двухосновная кислота (в водных растворах), плохо
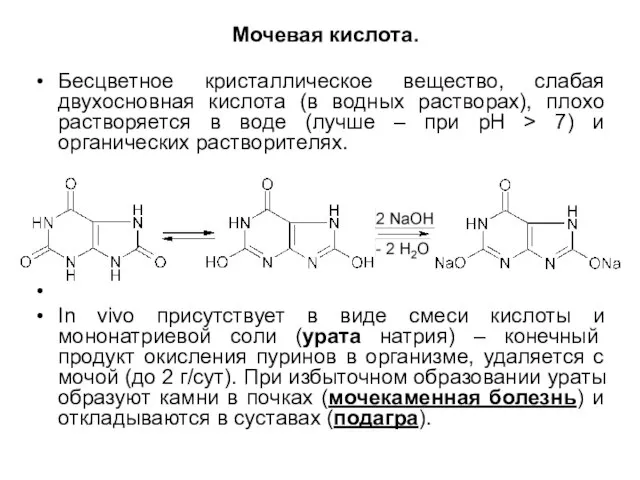
растворяется в воде (лучше – при рН > 7) и органических растворителях.
In vivo присутствует в виде смеси кислоты и мононатриевой соли (урата натрия) – конечный продукт окисления пуринов в организме, удаляется с мочой (до 2 г/сут). При избыточном образовании ураты образуют камни в почках (мочекаменная болезнь) и откладываются в суставах (подагра).
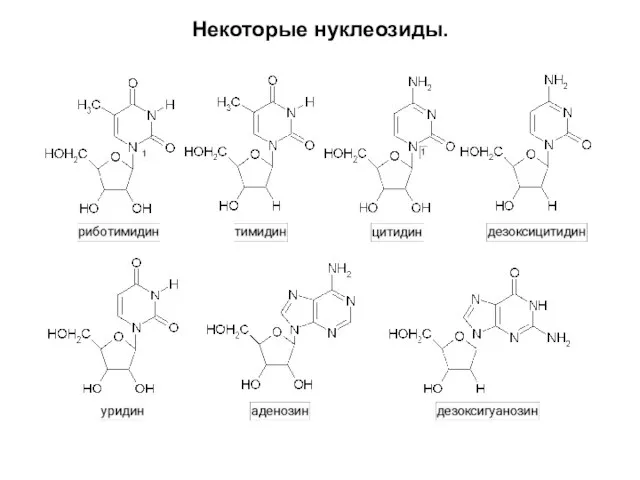
Слайд 9Нуклеозиды.
Нуклеозиды – природные β-N-гликозиды D-рибозы (рибонуклеозиды) или 2-дезокси-D-рибозы (дезоксирибонуклеозиды) с азотистыми

основаниями НК – твердые вещества, умеренно растворимые в воде и нерастворимые в органических растворителях – компоненты нуклеотидов и НК.
По природе углевода делятся на рибонуклеозиды и дезоксирибонуклеозиды.
По природе азотистого основания делятся на пиримидиновые и пуриновые.
Альдопентоза связана с азотистым основанием β-N-гликозидной связью, устойчивой в щелочной и нейтральной средах; в кислой среде in vitro нуклеозиды распадаются на компоненты (пуриновые легче, чем пиримидиновые). Пурины прикреплены к альдопентозе атомом N-9, пиримидины – атомом N-1.
Слайд 11Биороль нуклеозидов и азотистых оснований НК.
Составляющие компоненты нуклеотидов и НК.
Модифицированные

синтетические и полусинтетические азотистые основания (5-фторурацил, 6-меркаптопурин и др.) и нуклеозиды (фторафур, 3'-азидотимидин, рибавирин и др.) – большая группа лекарственных препаратов (противоопухолевые, противовирусные, противогрибковые и антибактериальные средства).
Слайд 12Нуклеотиды.
Нуклеотиды – большая группа фосфорных эфиров нуклеозидов, очень разнообразных по составу,

строению, свойствам, биологической роли, применению. Включают 3 основных компонента: азотистое основание, альдопентозы D-рибозу или 2-дезокси-D-рибозу, 1-3 остатка фосфорной кислоты в положениях 3' или 5' (обычно) остатка альдопентозы.
Нуклеотиды – это твердые вещества кислотной природы, хорошо растворимые в воде и основаниях, практически нерастворимые в органических растворителях. Умеренно устойчивы только в нейтральной среде, в кислой среде легко теряют азотистые основания, а в щелочной – фосфаты (гидролизуются).
Существуют и разрабатываются лекарственные препараты олигонуклеотидной природы.
Слайд 13Нуклеотиды можно классифицировать:
По количеству нуклеотидных звеньев:
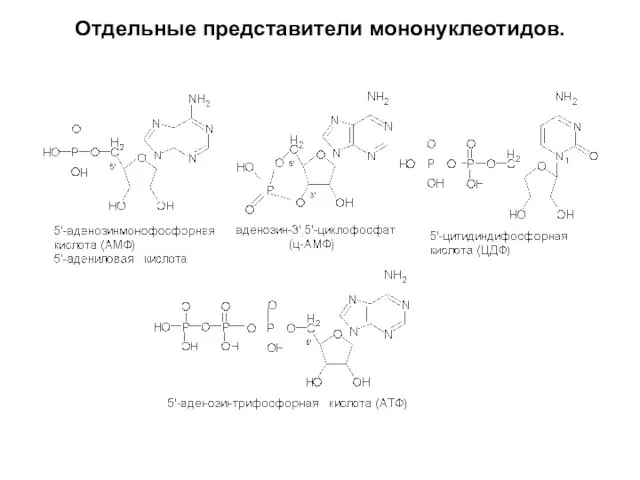
Мононуклеотиды – состоят из 1

азотистого основания, 1 углевода и остатков фосфорной кислоты (АМФ, ЦДФ, АТФ, ц-АМФ, ФМН и др.).
Динуклеотиды – состоят из двух мононуклеотидных остатков, связанных макроэргической фосфо-ангидридной связью – 2 азотистых оснований, 2 углеводов и 2 остатков фосфорной кислоты. (НАД+, НАДН, НАДФН, ФАД и др.).
Специальные нуклеотиды – состоят из 1 азотистого основания, 1 остатка D-рибозы, 2 остатков фосфорной кислоты и дополнительной группы – сульфата (ФАФС) или углевода (УДФ-глюкоза, УДФ-глюкуроновая кислота и др.).
Слайд 14Мононуклеотиды классифицируют:
По природе азотистого основания:
Пуриновые – содержат А, Г
Пиримидиновые

– содержат Т, Ц, У
Флавиновые (ФМН) – содержат изоаллоксазин
По природе альдопентозы:
Рибонуклеотиды – содержат β-D-рибофуранозу
Дезоксирибонуклеотиды – содержат 2-дезокси-β-D-рибофуранозу
ФМН содержит пятиатомный спирт рибитол
По количеству остатков фосфорной кислоты:
Нуклеозидмонофосфаты (1 остаток)
выделяют циклические нуклеотиды (ц-АМФ, ц-ГМФ)
Нуклеозиддифосфаты (2 остатка)
Нуклеозидтрифосфаты (3 остатка)
Слайд 15Отдельные представители мононуклеотидов.
Слайд 16Биороль мононуклеотидов.
Нуклеозидтрифосфаты (АТФ, ГТФ, ЦТФ и др.) используются в биосинтезе НК

и специальных нуклеотидов (УДФ-глюкоза, ФАФС).
Используются для регуляции метаболических процессов, АМФ и АДФ стимулируют выработку энергии в клетках, ц-АМФ и ц-ГМФ передают гормональный сигнал в клетку.
УДФ-глюкоза используется для синтеза гликогена, УДФ-глюкуроновой кислоты.
УДФ-глюкуроновая кислота и ФАФС используются для детоксикации ксенобиотиков и в биосинтезе полисахаридов - ГАГ соединительной ткани.
Слайд 17АТФ и её роль.
Важнейшие химические связи: β-N-гликозидная, сложноэфирная (фосфоэфирная), 2 макроэргических

(фосфо)ангидридных.
Важнейшее макроэргическое соединение человеческого организма, используется для кратковременного запасания энергии (менее 1 мин.) (обмен около 60 кг/сут).
Образуется в тканевом дыхании (окислительное фосфорилирование) и при субстратном фосфорилировании (ФЕП + АДФ → ПВК + АТФ)
Используется для активации и биосинтеза метаболитов, биосинтеза НК и ц-АМФ, для энергообеспечения физиологических процессов (секреция, клеточное деление и движение, мышечное сокращение и др.).
Слайд 18Биосинтез и метаболизм ФАФС и УДФ-глюкуроновой кислоты.
SO42- + 2 АТФ →
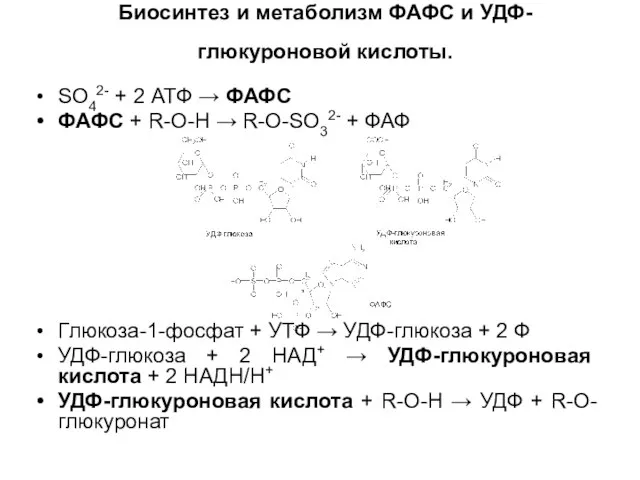
ФАФС
ФАФС + R-O-H → R-O-SO32- + ФАФ
Глюкоза-1-фосфат + УТФ → УДФ-глюкоза + 2 Ф
УДФ-глюкоза + 2 НАД+ → УДФ-глюкуроновая кислота + 2 НАДН/H+
УДФ-глюкуроновая кислота + R-O-H → УДФ + R-O-глюкуронат
Слайд 19Динуклеотиды.
Классифицируются на:
Пиридинсодержащие (НАД+ ↔ НАДН, НАДФ+ ↔ НАДФН) – содержат

никотинамидный нуклеотид, азотистые основания А и никотинамид, для биосинтеза необходим никотинамид (витамин РР)
Флавинсодержащие (ФАД ↔ ФАДН2) – содержит флавиновый мононуклеотид (ФМН), азотистые основания А и изоаллоксазин, для биосинтеза необходим рибофлавин (витамин В2)
Это важнейшие коферменты в ОВР in vivo; НАД+, НАДФ+, ФАД – окислители; НАДН, НАДФН, ФАДН2 – восстановители.
НАДН, ФАДН2 – субстраты тканевого дыхания, энергия их окисления кислородом запасается в форме АТФ (окислительное фосфорилирование).
Слайд 20Механизм работы НАД+ и НАДН.
Оксидазная реакция используется для получения энергии –тканевое
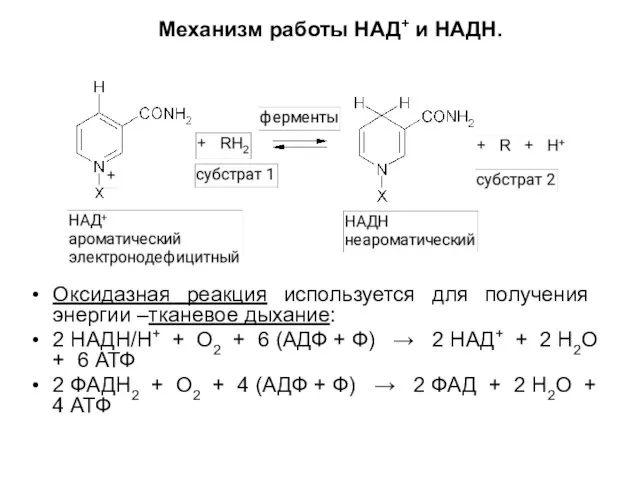
дыхание:
2 НАДН/Н+ + О2 + 6 (АДФ + Ф) → 2 НАД+ + 2 Н2О + 6 АТФ
2 ФАДН2 + О2 + 4 (АДФ + Ф) → 2 ФАД + 2 Н2О + 4 АТФ
Слайд 21Первичная структура нуклеиновых кислот.
Первичная структура НК – последовательность нуклеотидных остатков в
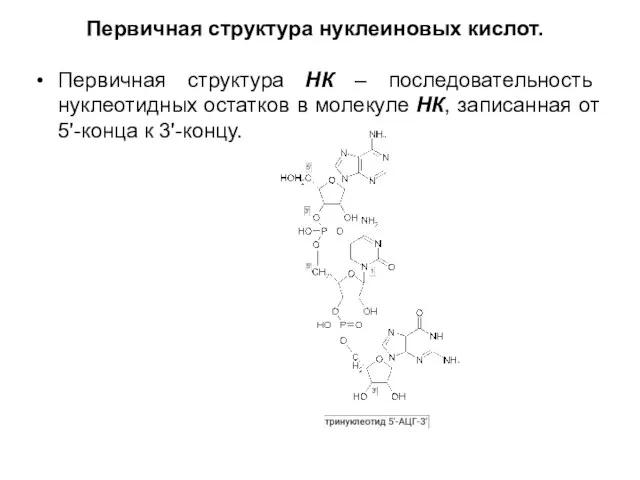
молекуле НК, записанная от 5'-конца к 3'-концу.
Слайд 22Вторичная структура ДНК
Предложена - 1953: Д. Уотсон, Ф. Крик.
Двойная правая антипараллельная спираль
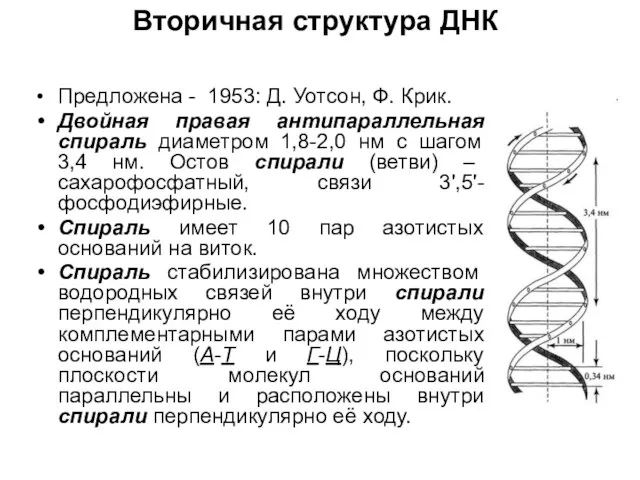
диаметром 1,8-2,0 нм с шагом 3,4 нм. Остов спирали (ветви) – сахарофосфатный, связи 3',5'-фосфодиэфирные.
Спираль имеет 10 пар азотистых оснований на виток.
Спираль стабилизирована множеством водородных связей внутри спирали перпендикулярно её ходу между комплементарными парами азотистых оснований (А-Т и Г-Ц), поскольку плоскости молекул оснований параллельны и расположены внутри спирали перпендикулярно её ходу.
Слайд 23Ядерная ДНК по составу подчиняется правилам Чаргаффа:
Количество А равно количеству Т, а

количество Г – количеству Ц (А = Т, Г = Ц).
Количество пуриновых азотистых оснований равно количеству пиримидиновых (А + Г = Т + Ц).
Транспортные и рибосомальные РНК не подчиняются правилам Чаргаффа.





















 Растворы электролитов (окончание)
Растворы электролитов (окончание) Занимательная химия в 8 классе
Занимательная химия в 8 классе Презентация на тему Оксид кремния
Презентация на тему Оксид кремния  Идентификация эфедрина гидрохлорида и дэфедрина
Идентификация эфедрина гидрохлорида и дэфедрина Презентация на тему Великие ученые-химики
Презентация на тему Великие ученые-химики  Презентация по Химии "Группа веществ, не требующих особых методов изолирования"
Презентация по Химии "Группа веществ, не требующих особых методов изолирования"  Основы химической термодинамики и термохимии
Основы химической термодинамики и термохимии Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Окислительно - восстановительные свойства серной кислоты
Окислительно - восстановительные свойства серной кислоты Получение углекислого газа и изучение его свойств. Практическая работа
Получение углекислого газа и изучение его свойств. Практическая работа Введение в биохимию
Введение в биохимию Строение атома
Строение атома Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота
Определение воды по Фишеру. Кислотное число, число омыления. Определение аминного азота Физические и химические явления
Физические и химические явления Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии
Презентация на тему Великие учёные, внёсшие значительный вклад в развитие химии 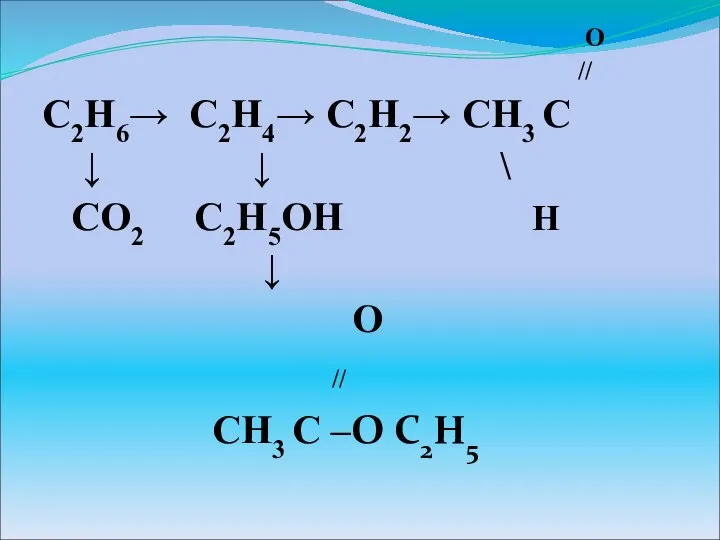 Органические соединения
Органические соединения Презентация на тему Фенол и его свойства
Презентация на тему Фенол и его свойства  Металлическая ионная ковалентная связи
Металлическая ионная ковалентная связи Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять
Навчальний проект Дослідження зміни концентрації CO2 у класній кімнаті під час занять Растворение. Растворы. Урок в 8 классе
Растворение. Растворы. Урок в 8 классе Растворы электролитов
Растворы электролитов Интеллектуальная игра По страницам истории химии
Интеллектуальная игра По страницам истории химии Лекция 1
Лекция 1 Материалы в промышленности
Материалы в промышленности Силикатная промышленность
Силикатная промышленность Природный газ
Природный газ Химия. Вещество
Химия. Вещество Электролиз
Электролиз