Содержание
- 2. Открытие Fe Знакомство же с железом относится к более позднему времени. Получать его некоторые народы научились
- 3. Строение атома Схема строения атома: +26 ) ) ) ) 2e 8e 14e 2e Электронная формула:
- 4. Получение В лабораторных условиях железо можно получить из его соединений следующими способами: восстановление железа из оксида
- 5. Чистое железо — серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород.
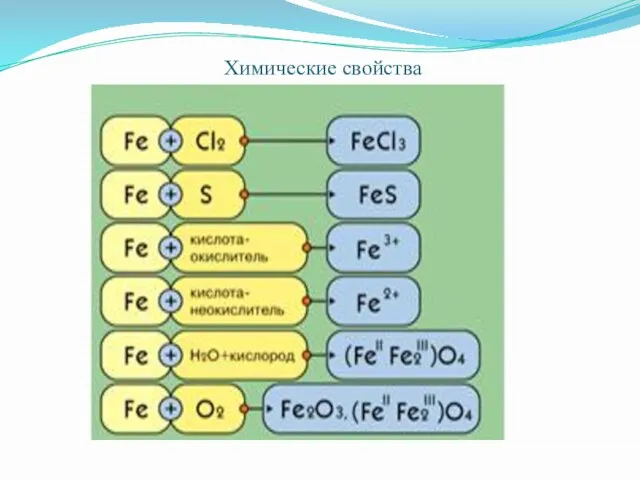
- 6. Химические свойства
- 7. Применение Применение железа в строительстве Применение железа строительной отраслью в наши дни нельзя переоценить, ведь металлоконструкции
- 9. Скачать презентацию
Слайд 2 Открытие Fe
Знакомство же с железом относится к более позднему времени. Получать
Открытие Fe
Знакомство же с железом относится к более позднему времени. Получать

его некоторые народы научились раньше, а некоторые — значительно позже. Дело в том, что самородное железо в природе почти не встречается. Предполагается, что первое железо, которое попало в человеческие руки, было метеоритного происхождения. Первые упоминания о железе встречаются около 5 тысяч лет назад, тогда оно ценилось дороже самородного золота, которое служило оправой для изделий из железа. Согласно историческим фактам племена, проживавшие на территории современной Армении, уже в начале третьего тысячелетия до нашей эры умели получать железо. В Египте и Древней Греции железо получали во втором, а в Китае — в середине 1-го тысячелетия до н. э.
Слайд 3 Строение атома
Схема строения атома:
+26 ) ) ) )
2e 8e 14e
Строение атома
Схема строения атома:
+26 ) ) ) )
2e 8e 14e

2e
Электронная формула: 1s22s22p63s23p63d64s2
Металл средней активности, восстановитель:
Fe0-2e-→Fe+2, окисляется восстановитель
Fe0-3e-→Fe+3, окисляется восстановитель
Основные степени окисления: +2, +3
Электронная формула: 1s22s22p63s23p63d64s2
Металл средней активности, восстановитель:
Fe0-2e-→Fe+2, окисляется восстановитель
Fe0-3e-→Fe+3, окисляется восстановитель
Основные степени окисления: +2, +3
Слайд 4Получение
В лабораторных условиях железо можно получить из его соединений следующими способами:
восстановление железа из оксида Fe2O3 водородом при
Получение
В лабораторных условиях железо можно получить из его соединений следующими способами:
восстановление железа из оксида Fe2O3 водородом при

нагревании:
Fe2O3+3H2−→−t2Fe+3H2O↑⏐⏐;
восстановление железа из его оксидов алюминием при нагревании:
Fe2O3+2Al−→−t2Fe+Al2O3;
электролиз водных растворов солей железа(II).
В промышленных условиях железо получают из руд, массовая доля железа в которых — не менее 16 %.
Чистое железо получают восстановлением из оксидов (железо пирофорное), электролизом водных растворов его солей (железо электролитическое), разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С. Особо чистое железо (99,99%) получают с помощью зонной плавки. Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах. Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом. Основную массу железа выплавляют в виде сталей (до 2% углерода) или чугунов (свыше 2% углерода).
Fe2O3+3H2−→−t2Fe+3H2O↑⏐⏐;
восстановление железа из его оксидов алюминием при нагревании:
Fe2O3+2Al−→−t2Fe+Al2O3;
электролиз водных растворов солей железа(II).
В промышленных условиях железо получают из руд, массовая доля железа в которых — не менее 16 %.
Чистое железо получают восстановлением из оксидов (железо пирофорное), электролизом водных растворов его солей (железо электролитическое), разложением пентакарбонила железа Fe(CO)5 при нагревании до t 250°С. Особо чистое железо (99,99%) получают с помощью зонной плавки. Технически чистое железо (около 0,16% примесей углерода, кремния, марганца, фосфора, серы и др.) выплавляют, окисляя компоненты чугуна в мартеновских сталеплавильных печах и в кислородных конверторах. Сварочное или кирпичное железо получают, окисляя примеси малоуглеродистой стали железным шлаком или путём восстановления руд твёрдым углеродом. Основную массу железа выплавляют в виде сталей (до 2% углерода) или чугунов (свыше 2% углерода).
Слайд 5Чистое железо — серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или
Чистое железо — серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или

в воде, содержащей кислород. Железо пластично, легко подвергается ковке и прокатке, t плавления 1539°С а t кипения 2862°С. Обладает сильными магнитными свойствами (ферромагнетик), хорошей тепло- и электропроводностью.
Ферромагнетик —такое вещество, которое при t ниже точки Кюри, способно обладать намагниченностью в отсутствие внешнего магнитного роля.
Температура Кюри – t , при которой его феррменитные свойства исчезают.
Ферромагнетик —такое вещество, которое при t ниже точки Кюри, способно обладать намагниченностью в отсутствие внешнего магнитного роля.
Температура Кюри – t , при которой его феррменитные свойства исчезают.
Слайд 6 Химические свойства
Химические свойства
Слайд 7Применение
Применение железа в строительстве
Применение железа строительной отраслью в наши дни нельзя переоценить,
Применение
Применение железа в строительстве
Применение железа строительной отраслью в наши дни нельзя переоценить,

ведь металлоконструкции являются основой абсолютно любого современного строения. В этой сфере Fe используется в составе обычных сталей, литейного чугуна и сварочного железа. Данный элемент находится везде, начиная с ответственных конструкций и заканчивая анкерными болтами и гвоздями.
Применение железа в медицине
Известно, что в каждом взрослом человеке содержится до 4 грамм железа. Этот элемент крайне важен для функционирования организма, в частности, для здоровья кровеносной системы (гемоглобин в эритроцитах). Существует множество лекарственных препаратов на основе железа, которые позволяют повышать содержание Fe во избежание развития железодефицитной анемии.
Использование железа в промышленности
Использование железа и его сплавов – чугуна и стали – это основа приборостроения и изготовления прочей техники. Благодаря цианидам и оксидам Fe функционирует лакокрасочная промышленность, сульфаты железа применяются при водоподготовке. Тяжелая промышленность и вовсе немыслима без использования сплавов на основе Fe+C. Словом, Железо – это незаменимый, но вместе с тем доступный и относительно недорогой металл, который в составе сплавов имеет практически неограниченную сферу применения.
Применение железа в медицине
Известно, что в каждом взрослом человеке содержится до 4 грамм железа. Этот элемент крайне важен для функционирования организма, в частности, для здоровья кровеносной системы (гемоглобин в эритроцитах). Существует множество лекарственных препаратов на основе железа, которые позволяют повышать содержание Fe во избежание развития железодефицитной анемии.
Использование железа в промышленности
Использование железа и его сплавов – чугуна и стали – это основа приборостроения и изготовления прочей техники. Благодаря цианидам и оксидам Fe функционирует лакокрасочная промышленность, сульфаты железа применяются при водоподготовке. Тяжелая промышленность и вовсе немыслима без использования сплавов на основе Fe+C. Словом, Железо – это незаменимый, но вместе с тем доступный и относительно недорогой металл, который в составе сплавов имеет практически неограниченную сферу применения.
Следующая -
Летописи и другие исторические сочинения Кристаллы. Виды
Кристаллы. Виды Общая характеристика криптона
Общая характеристика криптона Презентация на тему Химические свойства и применение алканов
Презентация на тему Химические свойства и применение алканов  Logo кроссворд первоначальные понятия. 8 класс
Logo кроссворд первоначальные понятия. 8 класс Химическая мозаика
Химическая мозаика Соединения галогенов
Соединения галогенов Начало репликации. Направление движения вилки репликации
Начало репликации. Направление движения вилки репликации Вещество. Свойства веществ
Вещество. Свойства веществ Электростанция в кармане
Электростанция в кармане Презентация по Химии "Анилин"
Презентация по Химии "Анилин"  Строение вещества
Строение вещества Алкадиены
Алкадиены Загрязнение почв пестицидами
Загрязнение почв пестицидами Строение вещества. Молекулы
Строение вещества. Молекулы Кислоты. 8 класс
Кислоты. 8 класс Превращения вещества
Превращения вещества Химия в косметологии
Химия в косметологии Плотность вещества
Плотность вещества Тяжелая вода
Тяжелая вода Взаимодействие с водой
Взаимодействие с водой Раздел 1
Раздел 1 Самородные металлы
Самородные металлы Алкены. Пентен- С5Н10
Алкены. Пентен- С5Н10 Презентация на тему Способы получения металлов
Презентация на тему Способы получения металлов  691614
691614 Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина)
Курсовая работа: синтез n - бензил – n – этилэтанамина (диэтилбензиламина) Презентация Microsoft PowerPoint
Презентация Microsoft PowerPoint Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций
Теоретико-графовый анализ информативности кинетических параметров механизмов химических реакций