Содержание
- 2. Растворы вокруг нас Все природные жидкости - растворы
- 3. Существуют ли чистые вещества? Квалификации химических веществ: «Тех.» Техн. чистый. Не менее основного вещества70% «Ч.» Чистый.
- 4. Абсолютно чистых веществ нет! Видишь суслика? — Нет. — И я не вижу. А он есть!
- 5. Классификация растворов Истинные и коллоидные растворы Растворы электролитов и неэлектролитов Растворы сильных и слабых электролитов Окрашенные
- 6. Что такое раствор? Смесь, как минимум, двух веществ. Чем отличается раствор от смеси? Однородный. Растворенное вещество
- 7. Что такое раствор? Фаза – однородная область пространства. Фаза – область пространства, описываемая единой термодинамической функцией.
- 8. Что такое раствор? Компонентами называют не общее число составляющих систему веществ, а такое их число, которое
- 9. Что такое раствор? Раствор – многокомпонентная однофазная система. Чем раствор отличается от соединения и смеси? Раствор
- 10. Типичные структуры железоуглеродистых сплавов. Сталь с 0,65% С (сетка феррита и перлит). Увеличено в 150 раз.
- 11. Примеры растворов и смесей Белильная известь Молоко Нефильтрованное пиво Древесина Кость Кровь Томатный сок Мясной бульон
- 12. Коллоидные растворы Это смеси. Очень тонкие. Растворы промежуточные между истинными растворами и взвесями с размером растворенных
- 13. Истинные растворы Истинные растворы – однофазные, термодинамически устойчивые системы, неограниченно стабильные во времени. Прозрачные системы. Движущими
- 14. Истинные растворы В химической практике наиболее важны растворы, приготовленные на основе жидкого растворителя. Именно жидкие смеси
- 15. Исинные растворы В конце XIX века в науке существовало 2 полярных взгляда на природу растворов. Один
- 16. Способы выражения концентраций
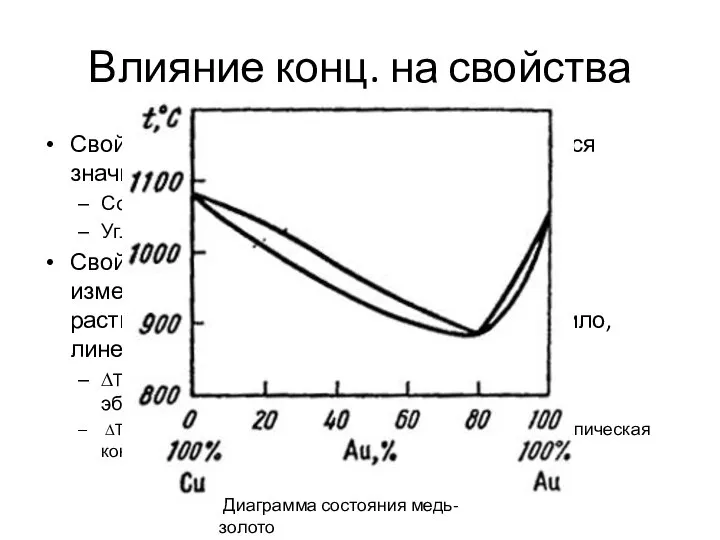
- 17. Влияние конц. на свойства Свойства растворенного вещества изменяются значительно. Соль. Была белой, твердой, тугоплавкой. Углекислый газ.
- 18. Закон Рауля Франсуа Мари Рауль
- 19. Концентрированные и разбавленные растворы.
- 20. Растворы электролитов Растворы веществ проводящих электрический ток. В XIX веке знали, что проводимость свойство заряженных частиц
- 21. Аррениус Отклонения от закона Рауля. Пришлось вводить i – изотонический коэффициент. Сванте Август Аррениус Так было
- 22. Сильные и слабые электролиты Сильные электролиты – хорошо проводят электрический ток. Распадаются на ионы полностью. Растворы
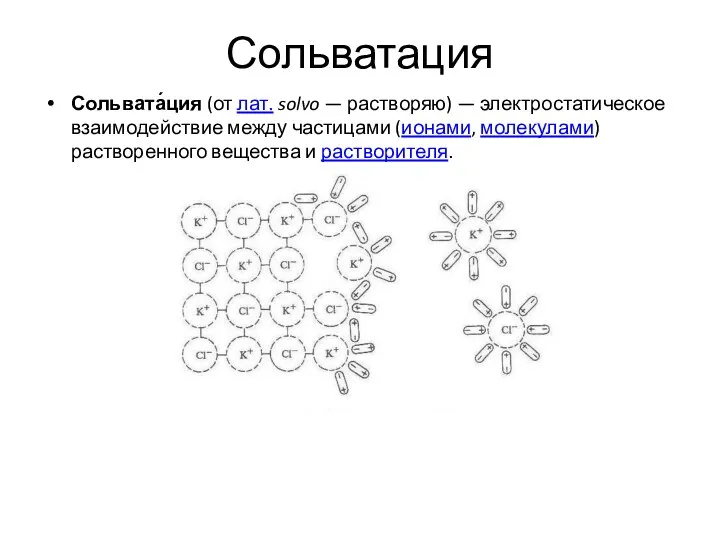
- 23. Сольватация Сольвата́ция (от лат. solvo — растворяю) — электростатическое взаимодействие между частицами (ионами, молекулами) растворенного вещества
- 24. Сольватация От алхимиков: Подобное в подобном. (лат. similia similibus curentur) Вода и масло Вода, I2 и
- 25. Концентрации сильных электролитов При растворении образуется всегда больше ионов, чем исходного вещества. NaCl → Na+ +
- 26. Уравнение электронейтральности
- 27. Правило фаз
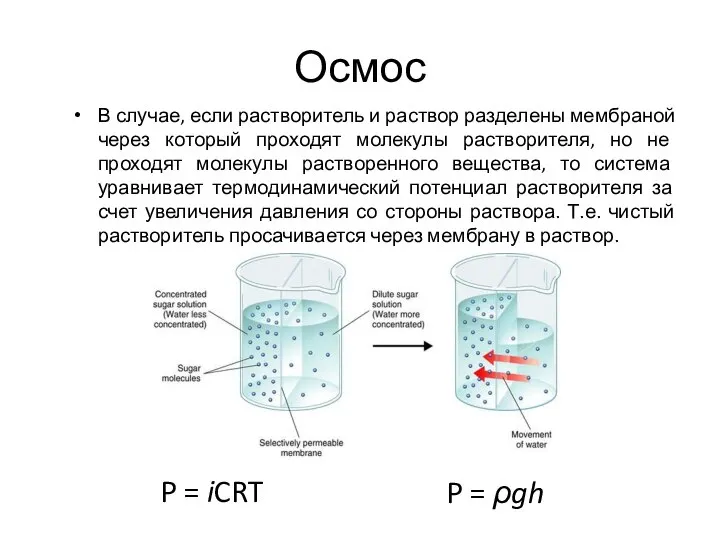
- 28. Осмос В случае, если растворитель и раствор разделены мембраной через который проходят молекулы растворителя, но не
- 29. Осмос Состояние эритроцита в растворах NаСI различной концентрации (в гипотоническом растворе - осмотический гемолиз).
- 31. Скачать презентацию
























 Углеводороды. Предельные (насыщенные) углеводороды
Углеводороды. Предельные (насыщенные) углеводороды Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева
Характеристика химического элемента по его положению в ПСХЭ Д.И.Менделева Металл XXI века титан
Металл XXI века титан Электролитическая диссоциация
Электролитическая диссоциация Технология переработки редкоземельного сырья
Технология переработки редкоземельного сырья Пробоотбор и пробоподготовка
Пробоотбор и пробоподготовка Использование комбинаторных задач для подсчета вероятностей
Использование комбинаторных задач для подсчета вероятностей Аммиак. Азот
Аммиак. Азот валентность (1)
валентность (1) Стекло. Определение стекла
Стекло. Определение стекла Изменения, происходящие с веществами. Физические явления в химии
Изменения, происходящие с веществами. Физические явления в химии Минералы алюминия
Минералы алюминия Определение формул органических веществ. Задачи для самостоятельного решения
Определение формул органических веществ. Задачи для самостоятельного решения Растительные источники жиров и жирных масел
Растительные источники жиров и жирных масел Степень окисления
Степень окисления Наука химия. Интеллектуальная игра. 5-8 класс
Наука химия. Интеллектуальная игра. 5-8 класс Вещество. Кристаллические решетки
Вещество. Кристаллические решетки Вода - это жизнь
Вода - это жизнь Классификация органических соединений. 10 класс
Классификация органических соединений. 10 класс Сложные реакции
Сложные реакции Материаловедение
Материаловедение Магматические породы
Магматические породы Алкины (ацетиленовые углеводороды)
Алкины (ацетиленовые углеводороды) Вода
Вода Самородные элементы. Сера. Лекция 7
Самородные элементы. Сера. Лекция 7 Применение муравьиного спирта
Применение муравьиного спирта Получение формальдегида методом дегидрирования метанола
Получение формальдегида методом дегидрирования метанола Презентация на тему Окислительно-восстановительные реакции
Презентация на тему Окислительно-восстановительные реакции