Содержание
- 2. Алкены (этиленовые углеводороды) это углеводороды, содержащие в молекуле одну двойную связь. CnH2n общая формула (n =
- 3. Физические свойства По физическим свойствам этиленовые углеводороды близки к алканам. При нормальных условиях углеводороды C2–C4 –
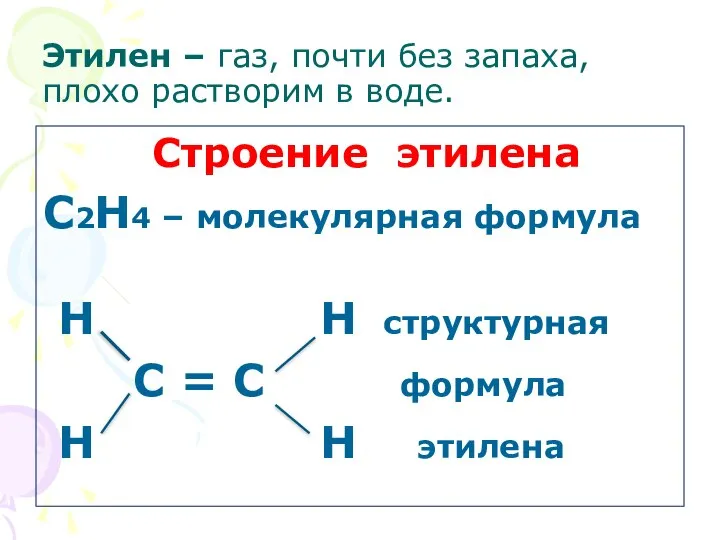
- 4. Этилен – газ, почти без запаха, плохо растворим в воде. Строение этилена С2Н4 – молекулярная формула
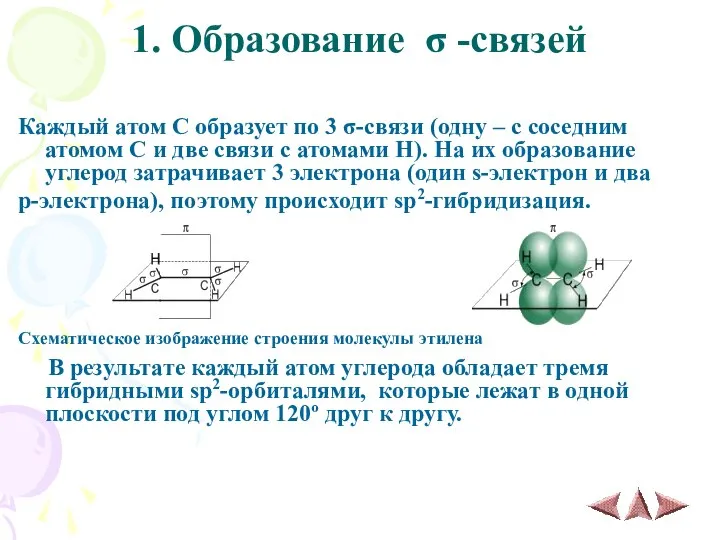
- 5. 1. Образование σ -связей Каждый атом С образует по 3 σ-связи (одну – с соседним атомом
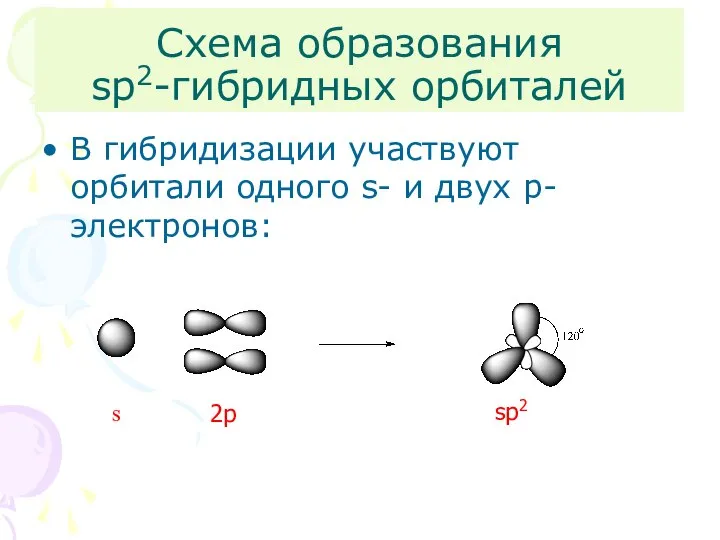
- 6. Схема образования sp2-гибридных орбиталей В гибридизации участвуют орбитали одного s- и двух p-электронов: s 2p sp2
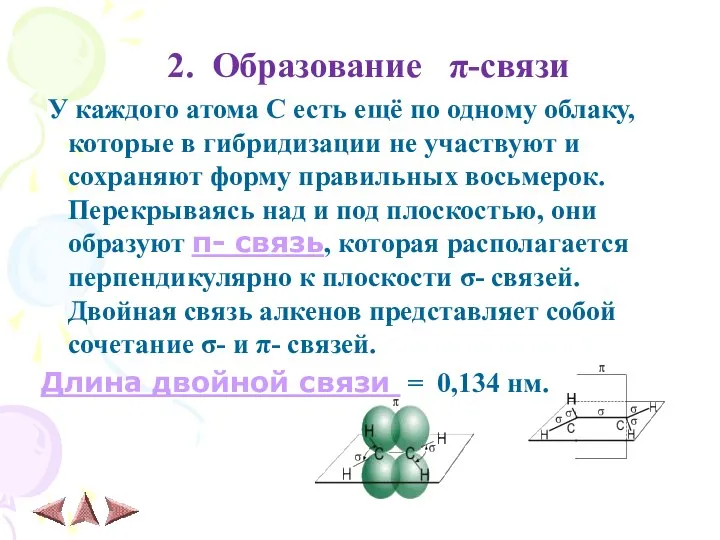
- 7. 2. Образование π-связи У каждого атома С есть ещё по одному облаку, которые в гибридизации не
- 8. Запомните. Простая (ординарная) связь – это всегда σ-связь. В кратных (двойных или тройных) связях – одна
- 9. π- связь менее прочна, чем σ- связь. В связи с этим, π- связь легко разрывается и
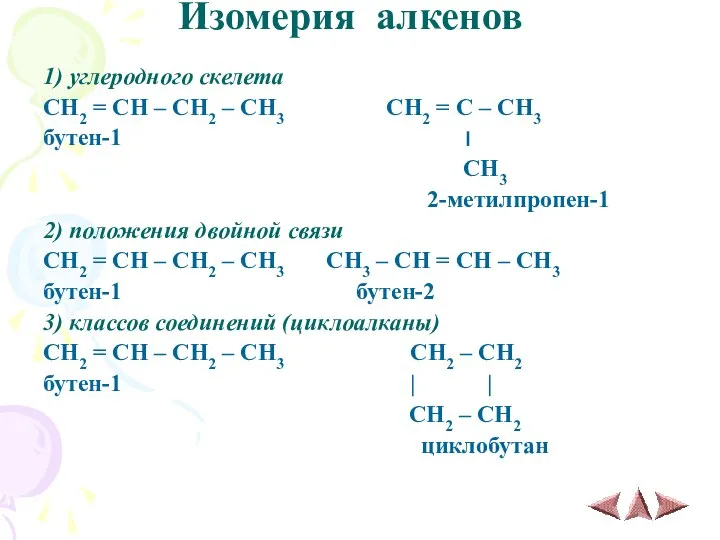
- 10. Изомерия алкенов 1) углеродного скелета CH2 = CH – CH2 – CH3 CH2 = C –
- 11. 4) пространственная (цис-транс-изомерия) CH3 H H H \ / \ / C = C C =
- 12. Номенклатура алкенов Название алкенов по систематической номенклатуре образуют из названий алканов, заменяя суффикс –ан на –ен,
- 13. Химические свойства алкенов 1) Горение При сжигании на воздухе алкены образуют углекислый газ и воду. C2
- 14. При окислении алкенов разбавленным раствором перманганата калия образуются двухатомные спирты – гликоли (реакция Е.Е.Вагнера). Реакция протекает
- 15. 3) Реакции присоединения. а) Присоединение галогенов - Галогенирование. Алкены при обычных условиях присоединяют галогены, приводя к
- 16. б) Гидрирование – присоединение водорода. Алкены легко присоединяют водород в присутствии катализаторов (Pt, Pd, Ni) образуя
- 17. Присоединение галогеноводородов к пропилену и другим несимметричным алкенам происходит в соответствии с правилом В.В.Марковникова (водород присоединяется
- 18. Гидратация. В присутствии минеральных кислот алкены присоединяют воду, образуя спирты. H+ CH3−C=CH2 + H2O → CH3−CH(CH3)−CH3
- 19. 4. Полимеризация - это процесс соединения многих маленьких одинаковых молекул в одну большую молекулу. При полимеризации
- 20. Вывод: Реакции присоединения, окисления и полимеризации алкенов идут за счет разрыва двойной связи ( π-связи).
- 21. Получение алкенов 1) Дегидрирование (отщепление водорода) алканов при повышенной температуре с катализатором. СН3 – СН3 →
- 22. Применение алкенов Алкены широко используются в промышленности в качестве исходных веществ для получения многих важнейших продуктов.
- 23. Этилен ускоряет созревание плодов
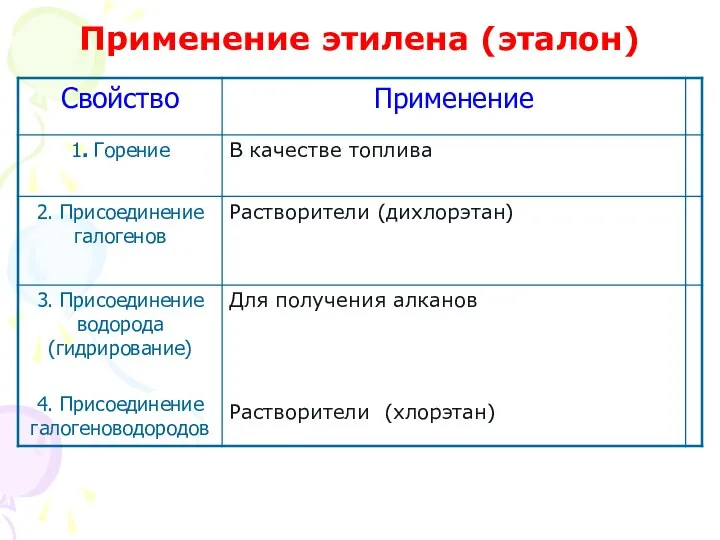
- 24. В качестве топлива
- 25. Для получения алканов
- 26. Этиленгликоль – для получения антифризов, тормозных жидкостей
- 27. Дихлорэтан – растворитель
- 28. Дихлорэтан – для борьбы с вредителями (окуривание зернохранилищ)
- 29. Дибромэтан – антидетонационная добавка в топливо
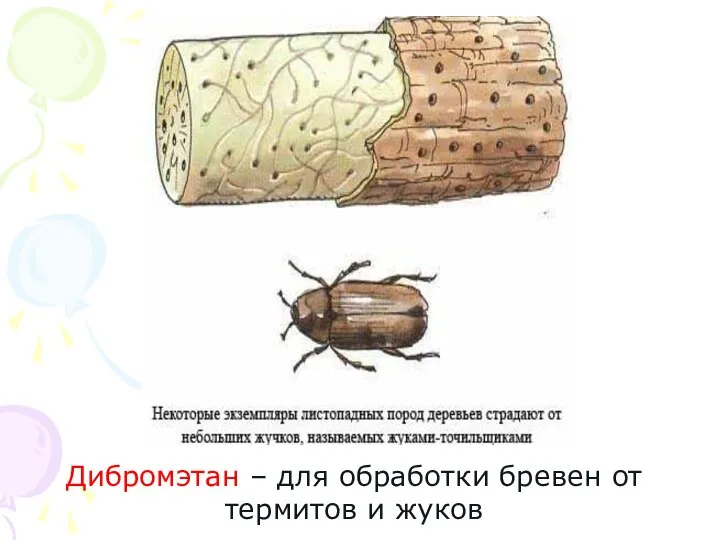
- 30. Дибромэтан – для обработки бревен от термитов и жуков
- 31. Хлорэтан, бромэтан – для наркоза при легких операциях
- 32. Этиловый спирт - растворитель, анти-септик в медицине , в производстве синтетического каучука…
- 33. Производство полиэтилена:
- 34. Содержание Алкены Номенклатура Изомерия Физические свойства Строение алкенов Химические свойстваХимические свойства (Химические свойства (реакцииХимические свойства (реакции
- 35. А) Пленка
- 36. Б) Тара
- 37. В) Трубы
- 38. Г) Сантехника
- 39. Д) Изоляция проводов и кабелей
- 40. Ж) Каркасы катушек
- 41. З) Бронепанели в бронежилетах
- 42. И) Предметы быта
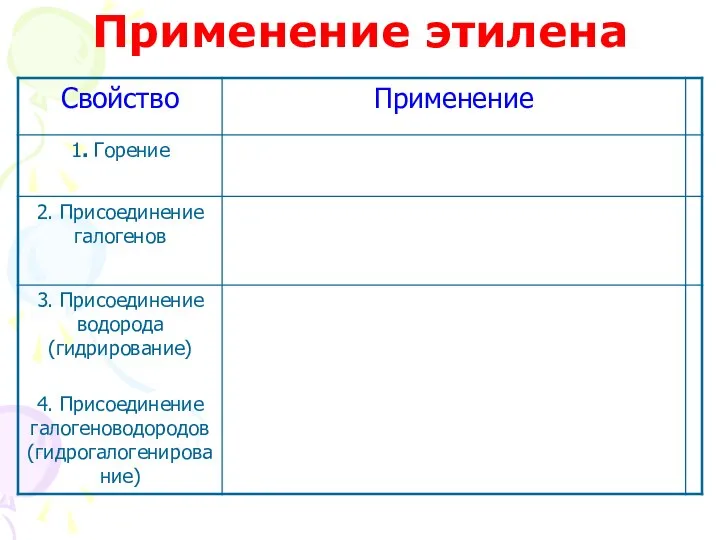
- 44. Применение этилена
- 46. Применение этилена (эталон)
- 48. Скачать презентацию



































 Химические средства защиты растений
Химические средства защиты растений Открытие Менделеева Д. И
Открытие Менделеева Д. И Классификация химических реакций. 11 класс
Классификация химических реакций. 11 класс Пластик и его применение в быту
Пластик и его применение в быту Пероксид щелочных металлов
Пероксид щелочных металлов Строение воды
Строение воды Презентация на тему Угольная и кремниевая кислоты и их соли
Презентация на тему Угольная и кремниевая кислоты и их соли  Алкины
Алкины Неорганические соединения фосфора
Неорганические соединения фосфора Оксиды
Оксиды Основы общей химии
Основы общей химии Избыток, недостаток. Решение задач
Избыток, недостаток. Решение задач Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы
Ферменттер.Ферменттердің құрылымы.Биохимиялық маңызы Презентация на тему Элементы главной подгруппы V группы
Презентация на тему Элементы главной подгруппы V группы  Классификация оганических соединений. 10 класс
Классификация оганических соединений. 10 класс Алкадиены. Строение. свойства и применение
Алкадиены. Строение. свойства и применение Великий закон Дмитрия Ивановича Менделеева
Великий закон Дмитрия Ивановича Менделеева Презентация на тему Самородки
Презентация на тему Самородки  Презентация на тему Признаки реакций
Презентация на тему Признаки реакций  Теория электролитической диссоциации. Контрольный тест
Теория электролитической диссоциации. Контрольный тест Хлор и хлороводород
Хлор и хлороводород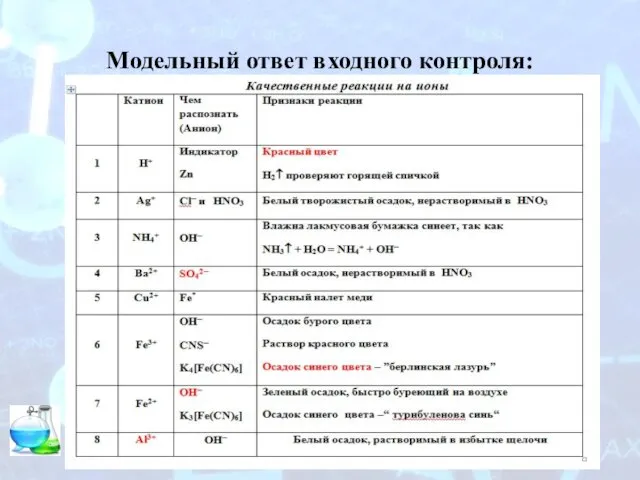 Модельный ответ входного контроля
Модельный ответ входного контроля Первоначальные химические понятия
Первоначальные химические понятия Окисление этанола оксидом меди
Окисление этанола оксидом меди Художественная обработка металла
Художественная обработка металла Алкины
Алкины Презентация на тему Химический алфавит
Презентация на тему Химический алфавит  Процессы минералообразования
Процессы минералообразования