Содержание
- 2. ВОПРОСЫ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ (ДАЁТСЯ ЗАРАНЕЕ) 1.Рукководствуясь строением атомов, характеризуйте общие свойства металлов и их классификации.
- 3. 4 период VIII группа побочная подгруппа +26Fe 2ē , 8ē , 14ē , 2ē Характерные степени
- 4. Природные соединения железа - магнетит - гематит - лимонит - пирит В водах многих минеральных источников
- 5. Магнетит (магнитный железняк) Fe3O4 (Fe2O3 · FeO) - содержит до 72% железа; - важнейшие месторождения в
- 6. Гематит (красный железняк, железный блеск) Fe2O3 - содержит до 65% железа; - важнейшие месторождения в России
- 7. Лимонит (бурый железняк) - содержит до 60% железа; - важнейшие месторождения в России – Урал, Забайкалье,
- 8. Пирит (железный или серный колчедан) - содержит до 47% железа; - важнейшие месторождения в России –
- 9. Физические свойства - серебристо-белый металл, быстро тускнеющий (ржавеющий) на влажном воздухе или в воде, содержащей кислород;
- 10. Получение железа 1. Алюминотермия. Fe2O3 + 2 AI = AI2O3 + 2 Fe 2. Прямое восстановление
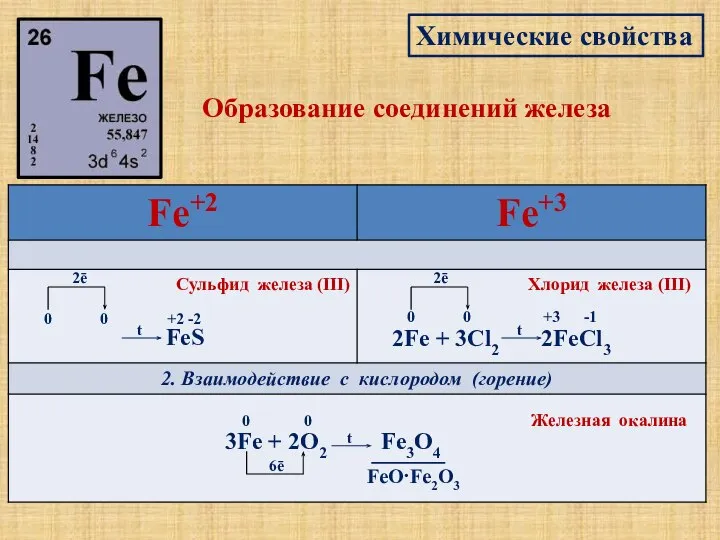
- 11. Химические свойства Образование соединений железа 1. Взаимодействие с неметаллами Fe + S 0 0 2ē t
- 12. Химические свойства Образование соединений железа 3Fe + 4H2O Fe3O4 + 4H2↑ +1 0 -2 +2 +3
- 13. Химические свойства Образование соединений железа Fe + 2HCl → FeCl2 + H2↑ 0 +1 0 -1
- 14. Химические свойства Образование соединений железа 2Fe+6H2SO4→Fe2(SO4)3+3SO2↑+6H2O +3 +4 +6 0 Fe+4HNO3→Fe(NO3)3+NO↑+2H2O 0 +5 +3 +2 t
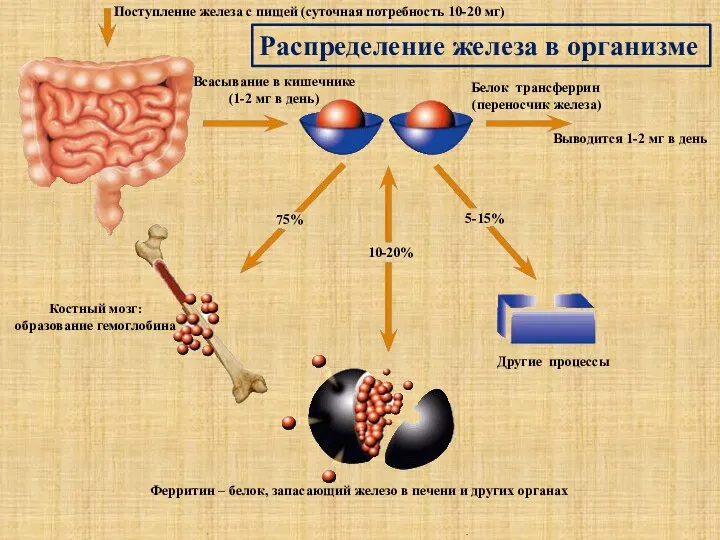
- 15. Поступление железа с пищей (суточная потребность 10-20 мг) Всасывание в кишечнике (1-2 мг в день) Белок
- 17. Скачать презентацию












 Строение комплексных соединений. Лекция 4
Строение комплексных соединений. Лекция 4 Химические реакции. Классификация
Химические реакции. Классификация Химическая технология. Структура ВКР
Химическая технология. Структура ВКР Действие активированного угля
Действие активированного угля Кислоты, их классификация и свойства
Кислоты, их классификация и свойства Химические средства защиты растений
Химические средства защиты растений Химическая кибернетика
Химическая кибернетика Силикатная промышленность
Силикатная промышленность Введение. Тренажер
Введение. Тренажер Реактор гидроочистки дизельного топлива
Реактор гидроочистки дизельного топлива Химическая кинетика. Лекция 4
Химическая кинетика. Лекция 4 Карбоновые кислоты
Карбоновые кислоты Соли, их классификация и свойства
Соли, их классификация и свойства Металлы (Ме)
Металлы (Ме) Фундаментальные механизмы биохимической адаптации
Фундаментальные механизмы биохимической адаптации Строение атома
Строение атома Типы химической связи
Типы химической связи Изотопы. Области применения изотопов
Изотопы. Области применения изотопов Галогенпроизводные алканов. Методы получения
Галогенпроизводные алканов. Методы получения Учебное задание Расчет теплоты сгорания
Учебное задание Расчет теплоты сгорания Основания. 8 класс
Основания. 8 класс Положение металлов в Периодической системе химических элементов Д.И.Менделеева
Положение металлов в Периодической системе химических элементов Д.И.Менделеева Гидролиз солей
Гидролиз солей ТЕСТ "Дисперсные системы"
ТЕСТ "Дисперсные системы" Строение веществ
Строение веществ Генетические ряды углеводородов. Обобщение и систематизация знаний
Генетические ряды углеводородов. Обобщение и систематизация знаний Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В.
Железо в продуктах питания. Подготовила ученица 9 «б» класса Чиженькова Ольга. Учитель: Шарапова О. В. Электролитическая диссоциация
Электролитическая диссоциация