Слайд 2Содержание
Понятие об антителах;
Строение антител;
Понятие о классах иммуноглобулинов;
Механизмы взаимодействия антител и антигенов;
Функции основных

классов иммуноглобулинов;
Образование антител
Слайд 3Антитела – это…?
Антитела – представляют собой гликопротеиновые молекулы, относящиеся к семейству иммуноглобулинов

(англ. immunoglobulins, Ig), способные специфически связываться с антигенами.
Термины «антитела» и «иммуноглобулины» являются синонимами в том смысле, что антитела можно рассматривать как специфические иммуноглобулины, избирательно реагирующие с эпитопами (участок молекулы антигена, распознаваемый иммунной системой) антигенов.
Антитела являются основными эффекторами адаптивного гуморального иммунного ответа.
Слайд 4Строение антитела
Их четвертичная структура включает в себя 4 полипептидные цепи: 2 легкие
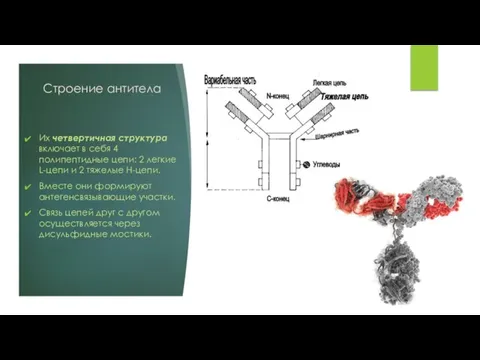
L-цепи и 2 тяжелые H-цепи.
Вместе они формируют антегенсвязывающие участки.
Связь цепей друг с другом осуществляется через дисульфидные мостики.
Слайд 5Строение антитела
Третичная структура L-цепей образована 2-мя доменами, один из них – вариабельный

(VL), а другой – константный (CL).
H-цепи образованы 4-5 доменами причем один из них также является вариабельным (VН), а остальные — константными (СН1−СН4).
Сочетание вариабельных доменов L- и H-цепей формирует два активных центра — антигенсвязывающие участки иммуноглобулина (паратопы).
Слайд 6Фрагменты антител
При обработке ферментом папаином молекула иммуноглобулина расщепляется на три фрагмента:
Два из
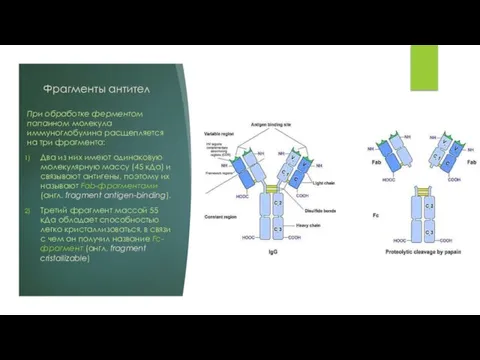
них имеют одинаковую молекулярную массу (45 кДа) и связывают антигены, поэтому их называют Fab-фрагментами (англ. fragment antigen-binding).
Третий фрагмент массой 55 кДа обладает способностью легко кристаллизоваться, в связи с чем он получил название Fc-фрагмент (англ. fragment cristallizable)
Слайд 7Классы иммуноглобулинов
Вариабельные домены, отличаясь исключительно высоким разнообразием внутри каждого организма (что отражено

в их названии), формируют огромное множество иммуноглобулинов, комплементарных различным антигенам, т.е. с различной антигенной специфичностью — идиотипы иммуноглобулинов. Другими словами, различные идиотипы отличаются между собой строением вариабельных доменов, образующих антигенсвязывающие участки.
Константные домены обусловливают структурно-функциональные особенности L- и H-цепей, определяющие их изотип.
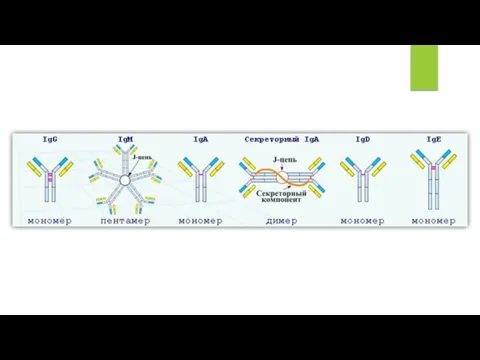
У человека существует 2 изотипа L-цепей (κ и λ) и 5 изотипов H-цепей (μ, δ, γ, ε, α). Изотип H-цепей определяет соответствующие классы иммуноглобулинов: IgM, IgD, IgG, IgE, IgA. Кроме того, дополнительные особенности γ и α Н-цепей позволяют выделить субклассы у некоторых иммуноглобулинов.
Структура иммуноглобулинов может варьировать от человека к человеку, в зависимости от индивидуальных генетических различий, обычно такие различия невелики и характеризуются вариабельностью некоторых аминокислотных остатков, входящих в состав тяжелых и легких цепей.
Слайд 9Классы иммуноглобулинов
IgA выделяются в полости и содержатся в секретах различных желез. Обеспечение
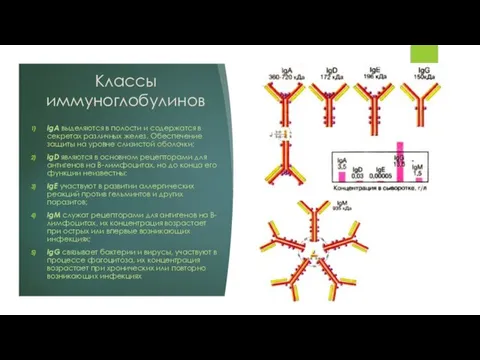
защиты на уровне слизистой оболочки;
IgD являются в основном рецепторами для антигенов на В-лимфоцитах, но до конца его функции неизвестны;
IgE участвуют в развитии аллергических реакций против гельминтов и других паразитов;
IgM служат рецепторами для антигенов на В-лимфоцитах, их концентрация возрастает при острых или впервые возникающих инфекциях;
IgG связывает бактерии и вирусы, участвуют в процессе фагоцитоза, их концентрация возрастает при хронических или повторно возникающих инфекциях
Слайд 10Механизмы взаимодействия антигенов и антител
Электростатические взаимодействия
Образуются между противоположно заряженными группами атомов антигенов

и антител. По-видимому, основная роль принадлежит связи между NH3+ и СОО– группами. Притяжение между этими группами имеет большое значение при взаимодействии между молекулами белка, что может приводить к изменению их конформации.
Силы Ван-дер-Ваальса
Являются силами притяжения, возникающими только на очень близких расстояниях, при перекрывании электронных облаков сблизившихся атомов. Они обусловлены электростатическим притяжением отрицательно заряженных электронов одного атома с положительно заряженным ядром другого атома.
Гидрофобные взаимодействия
Возникают в результате стремления гидрофобных групп к взаимной ассоциации, что ослабляет их связь с молекулами воды и приводит к возникновению сил притяжения между ними.
Слайд 11Откуда берутся антитела
Антитела выделяет особая разновидность B-клеток — плазматические клетки. Как и большинство секретируемых

белков, тяжёлые и лёгкие цепи иммуноглобулинов синтезируются рибосомами, находящимися на шероховатом эндоплазматическом ретикулуме (ЭПР).
В ходе синтеза образующаяся полипептидная цепь поступает в люмен ЭПР, где подвергается гликозилированию. Правильная укладка тяжёлых цепей и связывание с лёгкими цепями с образованием антитела регулируются шаперонами ЭПР.
После сборки молекулы антител освобождаются от шаперонов и поступают в аппарат Гольджи, где их углеводные остатки подвергаются дополнительному процессингу. Везикулы, содержащие зрелые антитела, отпочковываются от аппарата Гольджи и сливаются с клеточной мембраной, после чего мембранные формы антител остаются заякоренными в мембране клетки, а свободные антитела выходят в межклеточное пространство.
Слайд 12Плазматические клетки
По мере созревания B-лимфоциты в костном мозге экспрессия иммуноглобулинов претерпевает ряд

изменений. Самые ранние клетки B-лифоцитарного ряда, пре-B-лимфоциты, синтезируют только мембранные формы тяжёлых цепей класса μ.
Незрелые и зрелые B-лимфоциты синтезируют лёгкие цепи классов κ и λ, которые, соединяясь с тяжёлыми цепями класса μ, образуют антитела IgM.
Зрелые B-лимфоциты экспрессируют мембранные формы IgM и IgD, которые служат рецепторами, распознающими антигены и запускающими активацию B-лимфоцитов.
Когда B-лимфоциты активируются антигенами и другими стимулами, они превращаются в плазматические клетки, секретирующие антитела. При переходе к плазматическим клеткам доля секретируемых иммуноглобулинов по сравнению с мембранными резко возрастает. Кроме того, в это же время переходит переключение классов антител, и клетка перестаёт синтезировать IgM и IgD, но начинает выделять IgA, IgE или IgG.










 Гломерулонефриты
Гломерулонефриты Аккредитация медицинских работников в процессе становления специалиста среднего звена
Аккредитация медицинских работников в процессе становления специалиста среднего звена Волгоградское областное патологоанатомическое бюро
Волгоградское областное патологоанатомическое бюро Фармакотерапия в сестринской практике
Фармакотерапия в сестринской практике Инфекционные заболевания
Инфекционные заболевания ГЦР
ГЦР Растяжка. Пособие по практическому занятию
Растяжка. Пособие по практическому занятию Операции на конечностях. Операции на сосудах
Операции на конечностях. Операции на сосудах Продукты метаболизма
Продукты метаболизма Неврастения. Неврозы
Неврастения. Неврозы Хирургическая операция
Хирургическая операция Механизм и локализации обезболивающего действия наркотических анальгетиков. Роль опиатных рецепторов в реализации эффектов
Механизм и локализации обезболивающего действия наркотических анальгетиков. Роль опиатных рецепторов в реализации эффектов Организация работы эндоскопического подразделения медицинской организации
Организация работы эндоскопического подразделения медицинской организации Вакцинация от COVID-19
Вакцинация от COVID-19 Клиническая лабораторная диагностика как дисциплина
Клиническая лабораторная диагностика как дисциплина Выделение. Мочевыделительная система
Выделение. Мочевыделительная система Системная красная волчанка. Проявления в полости рта
Системная красная волчанка. Проявления в полости рта Культура питания. К чему может привести недоедание и переедание?
Культура питания. К чему может привести недоедание и переедание?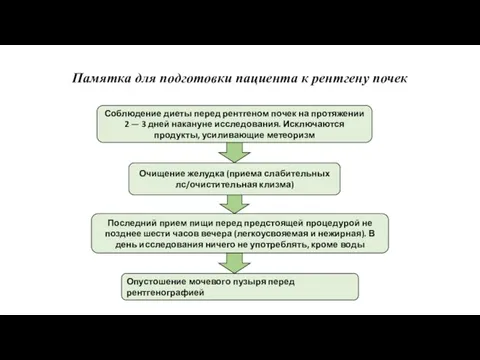 Памятка для подготовки пациента к рентгену почек
Памятка для подготовки пациента к рентгену почек Молибденосодержащие катализаторы эпоксидирования олефинов
Молибденосодержащие катализаторы эпоксидирования олефинов Артериальные доступы в рентгенохирургии. Методы гемостаза
Артериальные доступы в рентгенохирургии. Методы гемостаза Беременность и роды при миопии
Беременность и роды при миопии Тістерді салмамарға, штифттерге дайындау
Тістерді салмамарға, штифттерге дайындау Экстрагенитальные заболевания и беременность
Экстрагенитальные заболевания и беременность Врожденные пороки ЦНС плода
Врожденные пороки ЦНС плода Противовирусные средства
Противовирусные средства Анафилактический шок
Анафилактический шок Ребенок с проблемами интеллектуального развития в семье
Ребенок с проблемами интеллектуального развития в семье