Содержание
- 2. Функции мышц Локомоторная 2. Обеспечение подвижности организма и сопротивление механической силе, в том числе и статическим
- 3. МОЛЕКУЛЯРНЫЕ МОТОРЫ Трансформируют химическую энергию в механическую. Используются для сокращения, транспорта органелл, подвижности клеток, клеточного деления
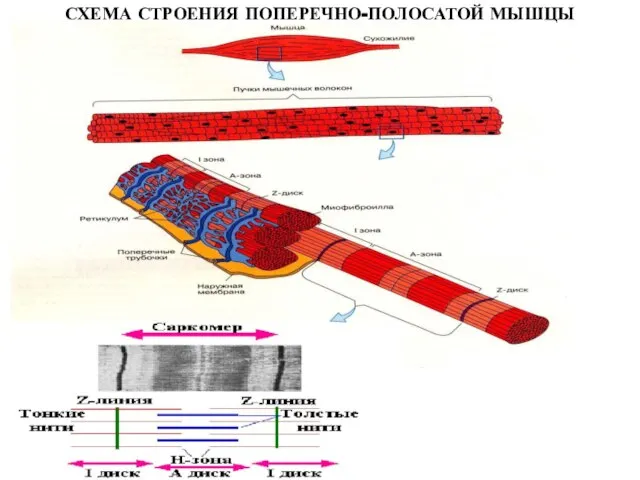
- 5. СХЕМА СТРОЕНИЯ ПОПЕРЕЧНО-ПОЛОСАТОЙ МЫШЦЫ
- 6. ХИМИЧЕСКИЙ СОСТАВ ПОПЕРЕЧНО-ПОЛОСАТЫХ МЫШЦ
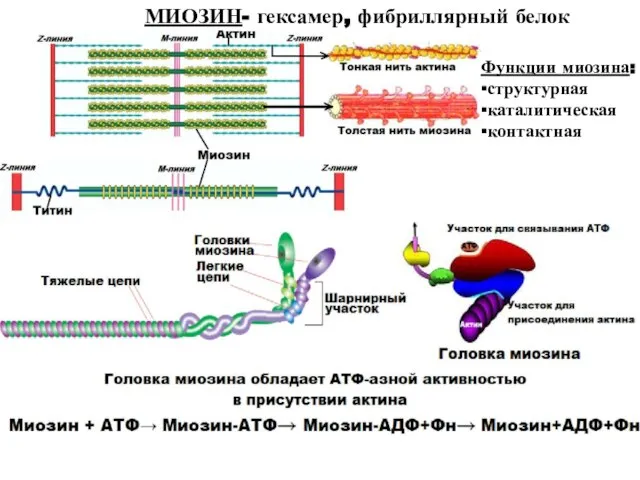
- 7. МИОЗИН- гексамер, фибриллярный белок Функции миозина: ▪структурная ▪каталитическая ▪контактная
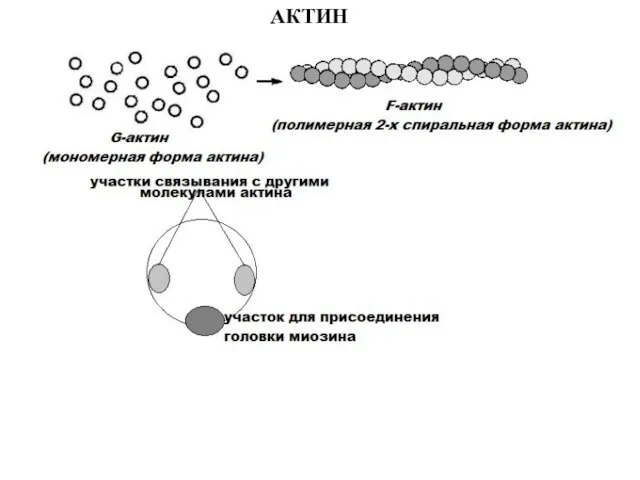
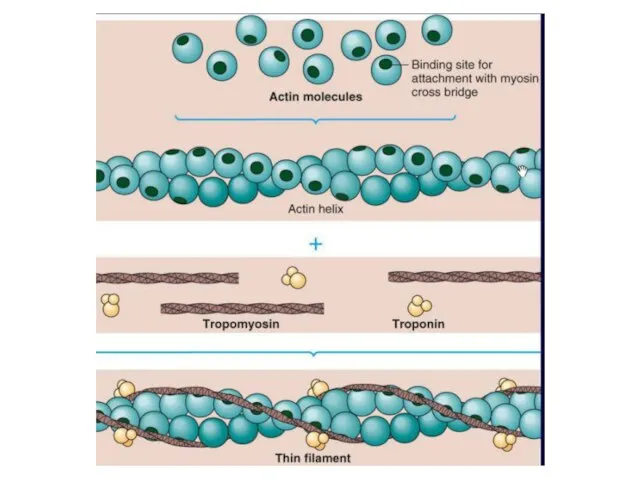
- 9. АКТИН
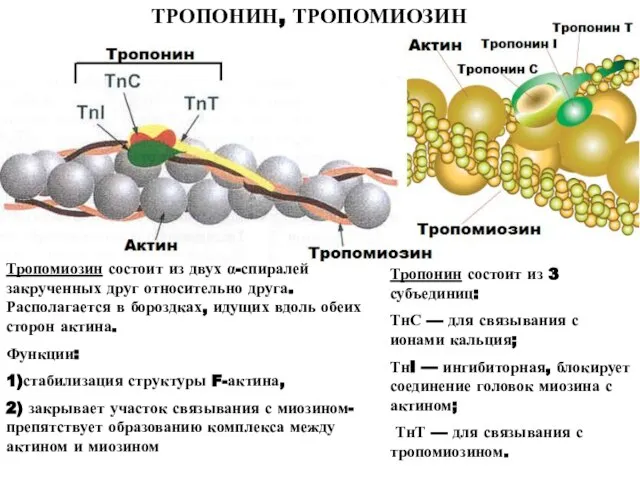
- 10. Тропомиозин состоит из двух α-спиралей закрученных друг относительно друга. Располагается в бороздках, идущих вдоль обеих сторон
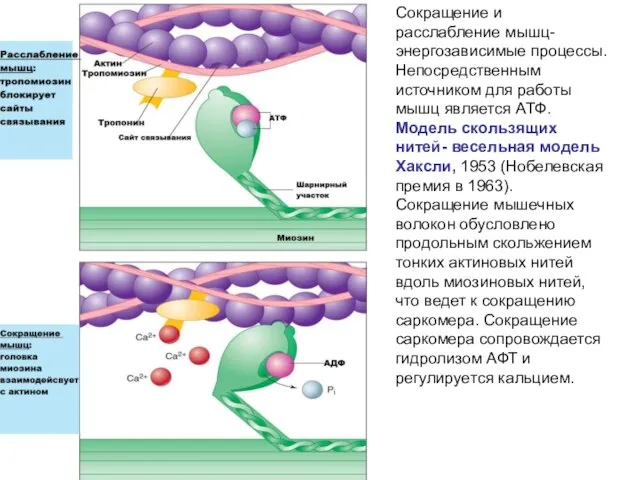
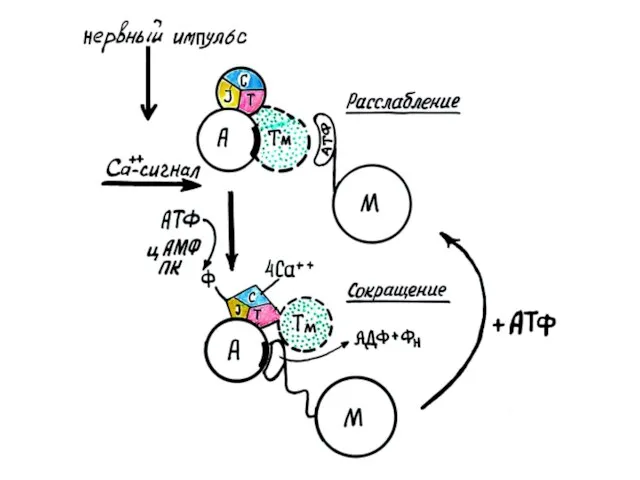
- 12. Сокращение и расслабление мышц- энергозависимые процессы. Непосредственным источником для работы мышц является АТФ. Модель скользящих нитей-
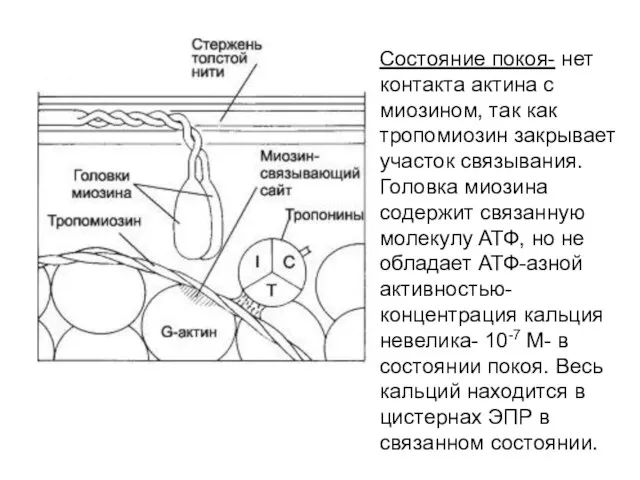
- 13. Состояние покоя- нет контакта актина с миозином, так как тропомиозин закрывает участок связывания. Головка миозина содержит
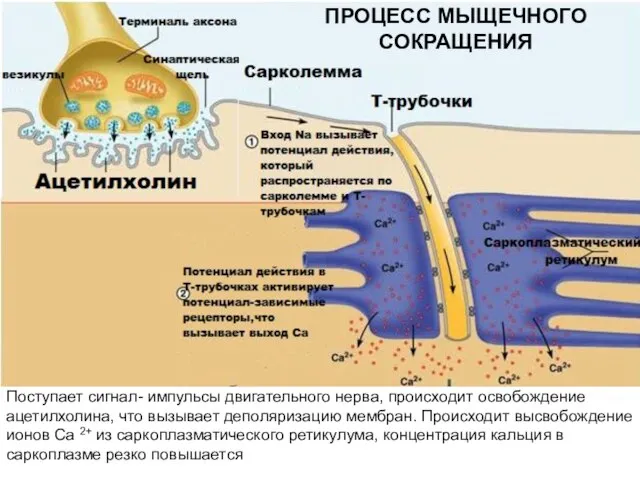
- 14. Поступает сигнал- импульсы двигательного нерва, происходит освобождение ацетилхолина, что вызывает деполяризацию мембран. Происходит высвобождение ионов Са
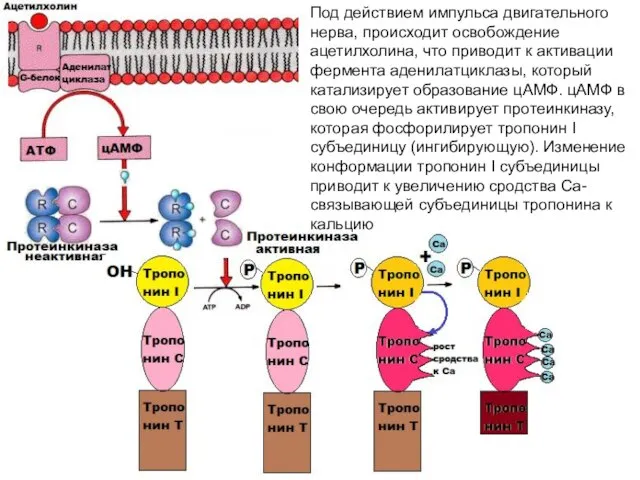
- 15. Под действием импульса двигательного нерва, происходит освобождение ацетилхолина, что приводит к активации фермента аденилатциклазы, который катализирует
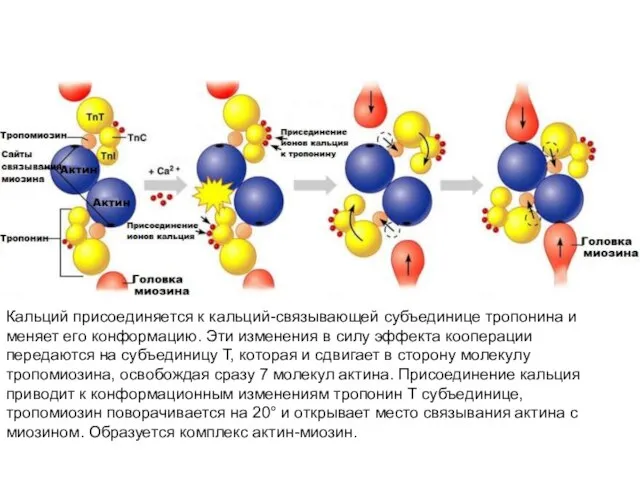
- 16. Кальций присоединяется к кальций-связывающей субъединице тропонина и меняет его конформацию. Эти изменения в силу эффекта кооперации
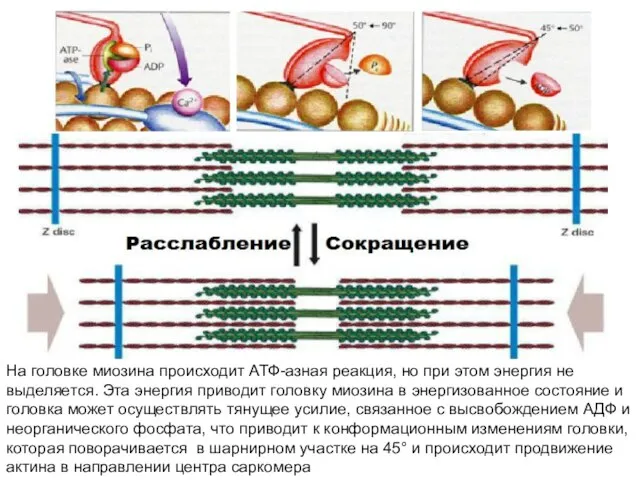
- 17. На головке миозина происходит АТФ-азная реакция, но при этом энергия не выделяется. Эта энергия приводит головку
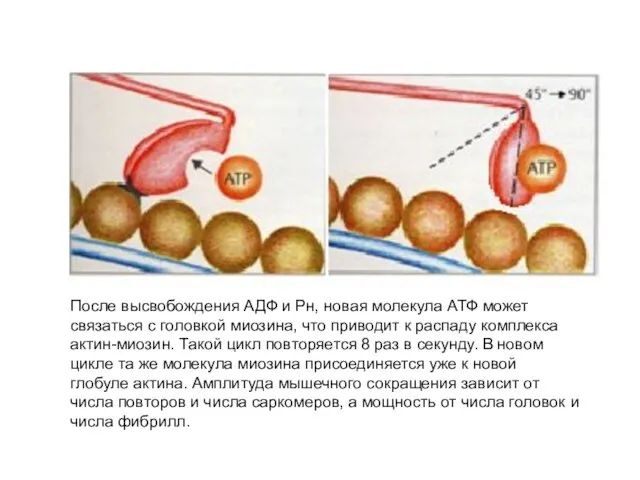
- 18. После высвобождения АДФ и Рн, новая молекула АТФ может связаться с головкой миозина, что приводит к
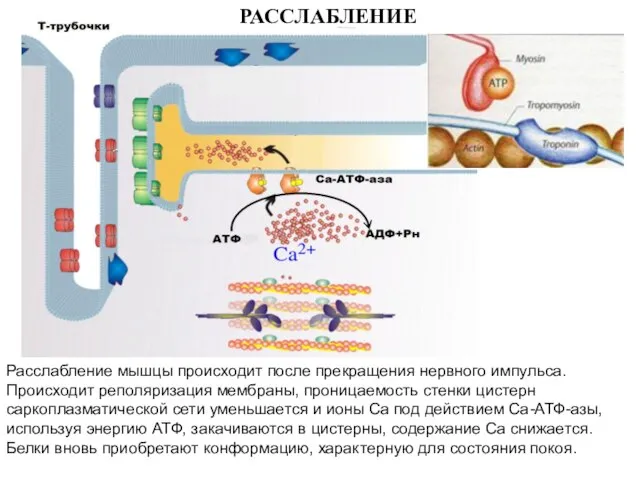
- 19. Расслабление мышцы происходит после прекращения нервного импульса. Происходит реполяризация мембраны, проницаемость стенки цистерн саркоплазматической сети уменьшается
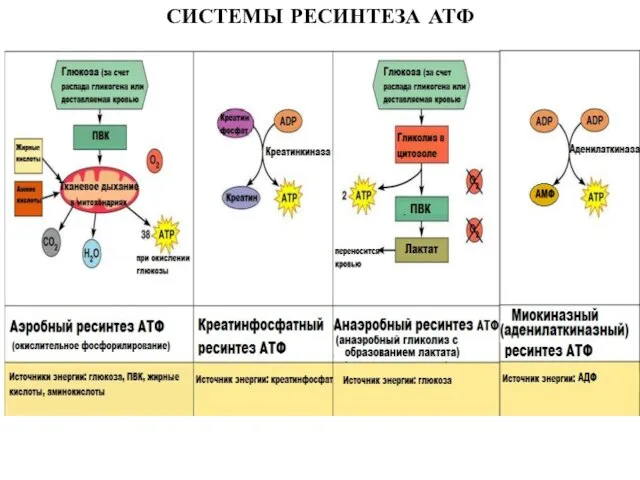
- 21. СИСТЕМЫ РЕСИНТЕЗА АТФ
- 22. на акт мышечного сокращения 2. на фосфорилирование тропонин I субъединицы 3. на синтез цАМФ 4. на
- 23. 1. Аэробный орган: 20% кислорода используется миокардом. 2. В 4 раз больше митохондрий, чем в скелетной
- 25. Скачать презентацию







 Скрининг в онкологии
Скрининг в онкологии Синдром Вольфа Паркинсона Уайта
Синдром Вольфа Паркинсона Уайта Реабилитационный центр Перекресток семи дорог
Реабилитационный центр Перекресток семи дорог Йод в жизни человека
Йод в жизни человека Хроническая сердечная недостаточность
Хроническая сердечная недостаточность Пиелонефрит
Пиелонефрит Проблема ожирения и избыточного веса в практике участкового терапевта
Проблема ожирения и избыточного веса в практике участкового терапевта Гипокальцемия у кошек
Гипокальцемия у кошек Гастрит - запалення слизової (внутрішній) оболонки стінки шлунка
Гастрит - запалення слизової (внутрішній) оболонки стінки шлунка Синдром Чедиака-Хигаси
Синдром Чедиака-Хигаси Методика для исследования мышления больных, процессов анализа и синтеза
Методика для исследования мышления больных, процессов анализа и синтеза Иммунная система
Иммунная система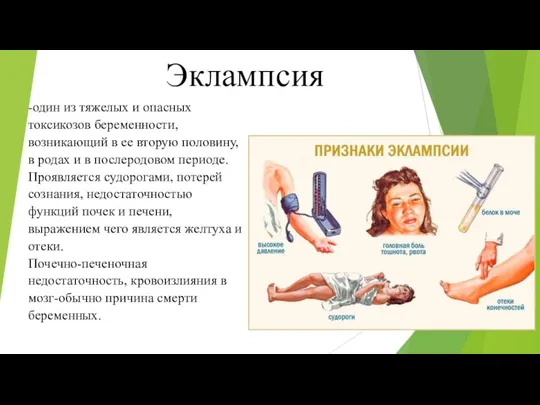 Эклампсия
Эклампсия Эффекты и механизмы действия вакуума на ткани раны
Эффекты и механизмы действия вакуума на ткани раны Трихомониаз, хламидиоз
Трихомониаз, хламидиоз Медико-валеологические основы здоровьесберегающего образования. (Лекция 1.2)
Медико-валеологические основы здоровьесберегающего образования. (Лекция 1.2) Экзаменационный билет. Препараты
Экзаменационный билет. Препараты Гиперчувствительность замедленного типа. Методы диагностики ГЗТ
Гиперчувствительность замедленного типа. Методы диагностики ГЗТ Сестринский процесс при сахарном диабете, диффузнотоксическом зобе, гипотиреозе
Сестринский процесс при сахарном диабете, диффузнотоксическом зобе, гипотиреозе Особенности осмотра детей с перинатальным поражением ЦНС, родившихся недоношенными
Особенности осмотра детей с перинатальным поражением ЦНС, родившихся недоношенными Общие правила выписывания рецептов. Часть 2
Общие правила выписывания рецептов. Часть 2 Экономическое обоснование выплат стимулирующего характера и критерии оценки эффективности труда медицинского персонала
Экономическое обоснование выплат стимулирующего характера и критерии оценки эффективности труда медицинского персонала Долевая пневмония
Долевая пневмония Анатомо-физиологические особенности печени
Анатомо-физиологические особенности печени Итоговая контрольная работа по темам: Физиология кровообращения; Физиология выделительной системы
Итоговая контрольная работа по темам: Физиология кровообращения; Физиология выделительной системы Вирус иммунодефицита человека. Лекция №2
Вирус иммунодефицита человека. Лекция №2 Диагностика и лечение пельвиоперитонита
Диагностика и лечение пельвиоперитонита Люпус- нефрит
Люпус- нефрит