Слайд 2 Фармакокинетика – раздел клинической фармакологии, изучающий движение ЛС в организме человека.

Слайд 3 Отражением фармакокинетики ЛС считается его концентрация в плазме крови, которая чаще

всего напрямую связана с концентрацией ЛС в области молекул мишеней. Концентрация ЛС в большинстве случаев связана с фармакологическими эффектами ЛС.
Слайд 4 Фармакокинетические параметры, описывающие изменение концентрации ЛС в плазме крови, могут быть

использованы для индивидуализации выбора ЛС и их режимов дозирования для обеспечения максимального эффективного и безопасного лечения.
Слайд 5 Для ряда препаратов существует возможность проведение терапевтического лекарственного мониторинга – изучение

концентрации ЛС в плазме крови пациента, при этом врач должен уметь скорректировать дозу ЛП в зависимости от получаемых результатов.
Слайд 6Фармакокинетичекая кривая
(кривая «концентрация-время»)
Фармакокинетическая кривая описывает движение ЛС и дает представление для

врача о «судьбе» ЛС в организме больного, что позволяет прогнозировать фармакологические эффекты и выбирать оптимальный режим дозирования ЛС.
Слайд 7Особенности фармакокинетики при различных путях введения ЛП
Характер фармакокинетической кривой зависит от

пути введения ЛП. Выбор врачом пути введения ЛП определяется несколькими факторами:
1. Временем, необходимым для достижения поставленных целей лечения;
2. Сопутствующими заболеваниями;
3. Необходимостью создания высоких концентраций препарата в органах-мишенях для повышения эффективности лечения и низких концентраций в крови для снижения риска системных НПР;
4. Удобством пациента.
Слайд 8Особенности фармакокинетики пероральных ЛП с модифицированным высвобождением
Многие пероральные ЛП выпускаются с

модифированным высвобождением ЛС. После проглатывания в кишечнике из данных лекарственных форм медленно высвобождается ЛС, что обеспечивает медленное всасывание и «нарастание» концентрации ЛС в плазме крови, а также ее удержание на определенном уровне в течение длительного времени и более длительный фармакологический эффект.
Слайд 9 Применение ЛП с модифицированным высвобождением позволяет снизить кратность приема ЛП до

1-2 раз в сутки, что существенно повышает приверженность пациента к назначению врача.
Слайд 10Лекарственные формы модифицированным высвобождением
1. Модифицрованный тип – это форма, содержащая полимерную матрицу,

в которую включены гранулы ЛС. В зависимости от конструкции матрицы формы матриксного типа могут быть в виде таблеток ретард и так называемых дурул.
Слайд 11 Таблетки ретард представляют собой форму, в которой гранулы ЛС окружены растворимой

в воде полимерной матрицей, а при попадании в кишечник матрица начинает послойно растворяться, что приводит к порционному высвобождению ЛС.
Слайд 12 Дурулы представляют собой форму, в которой ЛС включено в каркас из

нерастворимой матрицы. При этом высвобождение ЛС в кишечнике происходит путем вымывания из этой конструкции.
Слайд 132. Резервуарный тип представлен так называемой гастроинтестинальной терапевтической системой (GITS). Внутри таблетки

GITS с осмотической системой высвобождения нифедипина под кишечнорастворимой оболочкой находится контейнер с гранулами ЛС, а под ним – осмотически активная матрица.
Слайд 14 Когда таблетка попадает в кишечник, в матрицу попадает вода, она набухает

и постепенно выдавливает гранулы ЛС из контейнера.
Слайд 15 При назначении ЛП в форме с модифированным высвобождением пациент не должен

допустить нарушение целостности ЛП (нельзя ломать, дробить, раскусывать, разжевывать, стирать в порошок).
Слайд 16Это опасно по причинам:
ЛП становится короткодействующим, и его применение не способно пролонгировать

фармакологические эффекты, как ожидалось от его применения;
Больной может получить сразу большую дозу короткодействующего ЛП, иногда превышающую в несколько раз допустимую.
Слайд 17Как врачу интерпретировать информацию из раздела фармакокинетека?
Для того чтобы правильно использовать

информацию о ЛП из раздела «Фармакокинетика» инструкции и ТКФС, необходимо понимать клиническое значение каждого из представленных фармакокинетических параметров.
Слайд 18Общие положения о клиническом значении фармакокинетических параметров
В начале раздела обычно дается

характеристика всасывания при пероральном пути введения ЛС, при этом указывается доля препарата, которая подвергается всасывание.
Слайд 19 В некоторых инструкциях и ТКФС дается качественная характеристика полноты всасывания (например,

«абсорбция высокая», «абсорбция полная» или «плохо абсорбируется при приеме внутрь»). Если ЛС плохо всасывается после приема внутрь, то необходимо выбрать другие пути введения.
Слайд 20 Исключением считаются случаи, когда ЛС должно действовать непосредственно в просвете желудка

или кишечника (например, кишечные антисептики), тогда ЛС должно плохо всасываться, что обеспечивает низкий риск развития системных НПР.
Слайд 21 Биодоступность ЛС представляет собой долю ЛС (в процентах), достигшего системного кровотока

при внесосудистом пути введения. Биодоступность в инструкциях и ТКФС обычно указывается в процентах, при этом ее значение может существенно отличаться от характеристики полноты всасывания (например, у верапа-мила абсорбция составляет 95%, а биодоступность 10—20%).
Слайд 22 Это связно с тем, что биодоступность может быть низкой не только

в связи с плохим всасыванием, но и с метаболизмом в печени при первом прохождении ЛС по системе воротной вены. При низкой биодоступности, обычно используют не пероральный, а другие пути введения ЛС.
Слайд 23 Кроме того, зная биодоступность можно объяснить различия в рекомендованных дозах ЛС

при разных путях введения (например, разовая доза верапамила для перорального введения составляет 40—60 мг, а при внутривенном — 5—10 мг).
Слайд 24 При выборе ЛС у лактирующих женщин следует отдавать предпочтения ЛС с

низкой биодоступностью при приеме внутрь.
Слайд 25 Время наступления максимальной концентрации (Тmах) имеет большое клиническое значение для ЛС

с быстрым развитием фармакологических эффектов (антигипертензивные ЛС, антиангинальные ЛС).
Слайд 26 Для таких ЛС время наступления максимальной концентрации обычно совпадает со временем

развития максимально выраженного фармако-логического эффекта.
Слайд 27 Это значит, что подобные ЛС должны быть назначены таким образом, чтобы

время наступления максимальной концентрации совпадало с прогнозируемым временем максимально выраженного патологи-ческого процесса.
Слайд 28 ЛП в форме с модифицированным высвобождением время наступления максимальной концентрации, как

правило, более длительное, чем у короткодействующих форм. При назначении ЛС лактирующей женщине следует разводить кормление ребенка со временем наступления максимальной концентрации: оптимально перед очередным приемом ЛП.
Слайд 29 Связь с белками плазмы крови указывается в процентах.
При высокой степени

связи ЛС с белками плазмы крови (более 90%) при наличии у больного гипопротеинемии
или гипоальбуминемии следует начинать лечение с минимальной дозы
подобного ЛС.
Слайд 30 Ряд ЛС (фибраты, НПВС, сульфаниламиды) может вытеснять из связи с белками

плазмы крови другие ЛС, что особенно значимо также для ЛС, которые связываются с белками
плазмы крови более чем на 90%, при этом следует избегать подобных потенциально опасных комбинаций из-за высокого риска
развития НПР.
Слайд 31 Объем распределения (Vd) — это гипотетический объем жидкости организма, необходимой для

равномерного распределения всего
количества ЛС (введенной дозы) в концентрации, аналогичной концентрации в плазме крови. Объем распределения харак
теризует способность препарата распределяться в тканях: чем
больше объем распределения, тем лучше препарат распределяется в тканях.
Слайд 32 При большом объеме распределения для быстрого достижения терапевтических значений концентраций в

плазме крови необходимо применение нагрузочной дозы.
Слайд 33 При большом объеме распределения ЛС в случаях его передозировки, как правило,

малоэффективными становятся экстракорпоральные методы детоксикации (гемосорбция и т.д.), так как ЛС в основном находится в тканях, а не в крови.
Слайд 34 Период полувыведения - время, необходимое для снижения
концентрации ЛС в плазме крови

на 50%. С помощью периода
полувыведения, как правило, можно предсказать кратность применения ЛС.
Слайд 35 Как правило, при курсовом применении ЛС через 4—5 периодов полувыведения наступает

равновесное состояние (устанавливается равновесная концентрация — Css), при котором процессы поступления ЛС в организм больного и элиминации сравниваются, что соответствует наступлению стабильного фармакологического эффекта.
Слайд 36 Вот почему период полувыведения может быть использован для прогнозирования времени наступления

максимально стабильного фармакологического эффекта. Кроме того, после отмены ЛС обычно он не обнаруживается в организме больного через 4—5 периодов полувыведения, а значит, именно через этот промежуток времени можно ожидать полное прекращение действия ЛС.
Слайд 37 Биотрансформация ЛС в инструкции и ТКФС может формулироваться поразному: «быстро метаболизируется

печенью до неактивных метаболитов» или «практически не подвергается метаболизму». При этом, если указывается, что препарат метаболизируется в печени, то необходима коррекция дозы при нарушениях ее функции, особенно если ЛС имеет «эффект первого прохождения» через печень, которым обладают ЛС с высоким печеночным клиренсом.
Слайд 38 При применении ЛС у лактирующих женщин следует избегать применения ЛС, у

которых имеются активные метаболиты. В инструкции и ТКФС может быть указано, каким изоферментом цитохрома Р-450 метаболизируется ЛС (наиболее важные: CYP3A4, CYP2D6, CYP2C9, CYP2C19, CYP1A2).
Слайд 39 Если ЛС метаболизируется генетически полиморфным изоферментом цитохрома Р-450 (CYP2D6, CYP2C9, CYP2C19),

то это значит, что части пациентов (носителям полиморфизмов соответствующих генов) необходимо применение данных ЛС в минимальных дозах из-за генетически детерминированного снижения метаболизма ЛС.
Слайд 40 Под термином «экскреция ЛС», наиболее часто понимают процесс выведения ЛС или

его метаболитов из организма. Информация об экскреции ЛС в инструкции и ТКФС часто представлена в виде долевого распределения вклада органов в этот процесс.
Слайд 41 В случае если ЛС экскретируется с желчью в неизмененном виде, то

следует избегать применения таких ЛС у больных с обструкцией желчевыводящих путей. Необходимо корректировать дозу ЛС (проводить расчет дозы ЛС с учетом клиренса креатинина), если ЛС имеет узкий терапевтический диапазон и выводится почками в неизмененном виде более чем на 50%.
Слайд 42 Если указано, что ЛС способно проникать в грудное молоко, то следует

избегать его применения у лактирующих женщин.
Слайд 43Указание на хорошее проникновение ЛС, что прежде всего относится к антимикробным ЛС

(антибактериальные, противовирусные), через плацентарный барьер может быть показанием к применению ЛС для лечения или профилактики внутриутробной инфекции.
Слайд 44Если нет необходимости воздействия на плод, то при выборе ЛС у беременных

следует избегать применения ЛС, хорошо проникающих через плацентарный барьер.
Слайд 45Расчет нагрузочной дозы
Введение большой начальной, или нагрузочной дозы производится в случае

необходимости быстрого достижения целевых концентрация ЛС в области мишени. Это актуально для препаратов с большим объемом распределения, активно проникающих в органы и ткани, вследствие чего концентрация их в кровотоке после первых введений минимальна.
Слайд 46
Дозанагр=Vd * C
Где С – желаемая концентрация ЛС

Слайд 47Терапевтический лекарственный мониторинг
Терапевтический лекарственный мониторинг (ТЛМ) – это контроль над концентрацией

ЛС в плазме крови с целью подбора индивидуального режима дозирования препарата. Проводится для повышения эффективности и безопасности фармакотерапии.
Слайд 48 Конечная цель ТЛМ – это создание минимальной эффективной концентрации препарата в

крови путем подбора дозы ЛС.
Слайд 49ТЛМ используется в случаях:
ЛС обладает узким терапевтическим диапазоном;
Невозможно достичь терапевтического эффекта, используя

известные механизмы дозирования препарата;
Эффективность и безопасность ЛС сложно оценить клиническими методами;
Слайд 50ТЛМ используется в случаях:
Содержание ЛС в крови достоверно коррелирует фармакологическими эффектами ЛС,

в том числе и с НПР;
Под влиянием индивидуальных особенностей пациента или патологии изменена фармакокинетика ЛС, снижена эффективность лечения или повышен риск НПР;
ЛС назначают длительно, в том числе и пожизненно.
Слайд 51При проведении ТЛМ чаще всего оценивают значения минимальной или максимальной равновесной концентрации

ЛС в плазме крови.
Слайд 52Минимальная равновесная концентрация (Css min) – это концентрация ЛС в плазме крови

на фоне курсового его применения, при заборе крови перед очередным приемом ЛС.
Слайд 53Максимальная равновесная концентрация (Css max) – это концентрация ЛС в плазме крови

на фоне курсового его применения, при заборе крови через интервал времени после приема ЛС, соответствующий предполагаемому времени наступления максимальной концентрации.
Слайд 54Равновесная концентрация препарата обычно достигается через 4-5 периодов полувыведения, поэтому забор крови

для проведения ТЛМ необходимо проводить через данный промежуток времени.
Слайд 55Как проводить коррекцию доз при нарушениях функции печени?
Патология печени может вызвать разнообразные

изменения фармакокинетики ЛС, а следовательно, повлиять на его эффективность и безопасность.
Слайд 56Элиминация ЛС печени осуществляется:
Пресистемным метаболизмом («эффект первого прохождения»);
Печеночный клиренс – извлечение и

инактивация ЛС из системного кровотока гепатоцитами.
Слайд 57 К основным факторам, влияющим на метаболизм печени, относятся активность печеночных ферментов
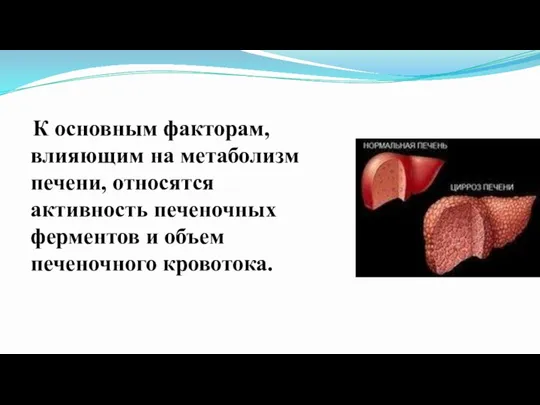
и объем печеночного кровотока.
Слайд 58В обычной практике дать точную оценку этим показателям невозможно. Поэтому необходимо:
Определить,

в какой степени ЛС метаболизируется и элиминируется, т.е. нужна или нет коррекция дозы.
Слайд 59 Как правило, о высоком печеночном клиренсе свидетельствуют высокие значения показателя первого

прохождения через печень и низкая биодоступность (<40%).
Слайд 60 Необходимо помнить, что ЛС может метаболизироваться в печени и не обладать

«эффектом первого прохождения». Тогда в ТКФС можно встретить примерно следующую формулировку: «метаболизируется до неактивных метаболитов в печени», следует, что при патологии печени дозу такого препарата необходимо снизить.
Слайд 612. Рассмотреть возможность использование ЛС с аналогичными фармакологическими эффектами, не подвергающемся метаболизму

в печени.
Слайд 623. Если альтернатива невозможна, необходимо провести коррекцию дозы ЛС. С этой целью

определяют степень снижения функции печени.
3.1. коррекция дозы ЛС при заболеваниях печени, основанная на оценки степени нарушения функции по шкале Чайлда-Пью.
Слайд 63Шкала для оценки нарушения функции печени Чайлда-Пью

Слайд 64 Коррекция дозы ЛС, метаболизирующихся в печени, осуществляется:
Класс А (5-6 баллов) –

компенсированный цирроз коррекции не требуется;
Класс В (7-9 баллов) – компенсированный цирроз снизить дозу ЛС на 25%;
Класс С (10-15 баллов) декомпенсиро-ванный цирроз снизить дозу ЛС на 50% (для ЛС без «эффекта первого прохождения») и на 75% для ЛС с «эффектом первого прохождения»).
Слайд 653.2. Коррекция дозы ЛС при заболеваниях печени, основанная на оценке белоксинтезирующей функции

(по уровню альбумина плазмы крови).
Слайд 66 Если концентрация альбумина в сыворотке крови меньше чем 30 г/л, то

дозу уменьшают на 50% для ЛС, обладающих «эффектом первого прохождения», и на 25% для ЛС не обладающих «эффектом первого прохождения».
Слайд 67Как проводить коррекцию дозы при нарушении функции почек?
Поскольку уремические токсины нарушают связывание

ЛС с белками плазмы и процессы метаболизма в печени, назначение любого ЛС требует особой осторожности.
Слайд 68Важным фармакокинетическим параметром, на который следует обратить внимание при расчете дозы, становится

доля препарата, выводимая почками в неизменном виде или в виде активных метаболитов (так называемая почечная фракция fu).
Слайд 69 Именно с помощью этого показателя рассчитывается доза ЛС при почечной недостаточности,

что необходимо при применении:
ЛС с узким терапевтическим диапазоном, которые выводятся почками в неизменном виде более чем на 50%;
ЛС, не считающихся ЛС с узким терапевтическим диапазоном, которые выводятся в неизменном виде более чем на 75%.
Слайд 70Показатель клиренса креатинина рассчитывают по формуле Кокрофта-Гаулта:
Cl креатинина= (140-возраст)*масса тела/концентрация креатинина плазмы*50

Слайд 71Следует отметить, что при почечной недостаточности происходит увеличение периода полувыведения многих ЛС

и в результате их кумуляция в организме, поэтому требуется изменение не только дозы, но и кратности введения препаратов.
Слайд 72ОСНОВНЫЕ ВОПРОСЫ ФАРМАКОКИНЕТИКИ
Пути введения ЛС
Всасывание ЛС
Биодоступность ЛС
Распределение ЛС
Связывание ЛС с белками

крови и тканей
Выведение ЛС
Кинетика метаболитов
Зависимость фармакокинетики от дозы и времени
Режимы дозирования ЛС
Биоэквивалентность ЛС
Слайд 73Пути введения лекарственных средств
От пути введения ЛС во многом зависит возможность попадания

его в место действия (например, в очаг воспаления), а также эффективность лечения в целом. Все пути введения имеют определенные преимущества и недостатки, знание которых необходимо для того, чтобы добиться оптимального терапевтического эффекта при различной патологии.
Слайд 74Общая схема фармакокинетических процессов лекарственных веществ
Чаще всего лекарства вводят энтерально:
Внутрь (per os);
Сублингвально;
Буккально;
Ректально

(per rectum)/
Достоинством такого способа введения является его удобство (не требуется помощи медицинского персонала), а также сравнительная безопасность и отсутствие осложнений, характерных для парентерального применения. ЛС, вводимые энтерально, могут оказывать как местное (некоторые противомикробные, противогрибковые и противоглистные средства), так и системное действие.
Слайд 75Пути введения ЛС
При парентеральных путях введения ЛС доставляется в организм, минуя

пищеварительный тракт:
Внутривенно;
Внутриартериально;
Внутримышечно:
Подкожно;
Интратекально (эндолюмбально, интравентрикулярно, внутрибрюшинно, внутриплеврально, в полость абсцесса и т.д.);
Слайд 76Пути введения ЛС
Перидурально;
Местно (накожно, субконьюнктивально, интраназально и т.д.);
Ингаляционно.
Разработаны также лекарственные формы, предназначенные

для хронического введения с помощью имплантируемых дозаторов и помп.
Слайд 77Прием внутрь через рот (peros)
При лечении заболеваний внутренних органов перорально следует назначать

ЛС, которые хорошо всасываются слизистой оболочкой желудка или кишечника. Если необходимо создать высокую концентрацию препарата в ЖКТ, наоборот, используют ЛС которые плохо всасываются, что позволяет получить необходимый местный эффект при отсутствии системных побочных реакций.
Например, прием внутрь аминогликозидных антибиотиков с целью деконтаминации кишечника; применение невсасывающихся антацидов.
При тяжелом течении некоторых заболеваний, например дизентерии, желательно, чтобы концентрация ЛС была высокой как в просвете кишечника, так и в крови.
Слайд 78Прием внутрь через рот (peros)
Внутрь ЛС вводят в форме растворов, порошков, таблеток,

капсул, пилюль. Чтобы предотвратить раздражающее действие некоторых лекарств на слизистую оболочку желудка, используют таблетки, покрытые пленками, устойчивые к действию желудочного сока, но распадающиеся в щелочной среде кишечника.
Слайд 79Прием внутрь через рот (peros)
Недостатками перорального пути введения ЛС при необходимости получения

системного эффекта являются:
Относительно медленное наступление терапевтического эффекта;
Возможность больших индивидуальных различий в скорости и полноте всасывания;
Влияние пищи и других ЛС на всасывание;
Слайд 80Прием внутрь через рот (peros)
Невозможность применения лекарств, плохо абсорбирующихся слизистой оболочкой желудка

и кишечника (например, стрептомицина), разрушающихся в просвете желудка и кишечника (инсулин, окситоцин и т.д.) либо при прохождении через печень (гормоны), а также веществ, оказывающих сильное раздражающее действие на слизистую ЖКТ;
Невозможность (или неудобство) ввода ЛС через рот при рвоте, желудочно-кишечном кровотечении и бессознательном состоянии больного.
Слайд 81Прием внутрь через рот (peros)
Рекомендации. Следует помнить, что некоторые таблетки и капсулы

в случае их приема больными в положении лежа могут задерживается в пищеводе и вызывать его изъязвление, особенно у пожилых людей, у которых нарушена перистальтика. Для профилактики этого осложнения таблетки и капсулы следует запивать большим количеством воды.
Имеются специальные лекарственные формы для приема внутрь, обеспечивающие постепенное, замедленное высвобождение действующего вещества в ЖКТ, что позволяет пролонгировать терапевтическое действие препаратов. В основе их создания лежат специальные технологии, обеспечивающие замедленное высвобождение лекарственного вещества с постоянной скоростью в течение длительного времени (slow release, extended release).
Слайд 82Прием внутрь через рот (peros)
Ретардные лекарственные формы не подлежат дроблению, если отсутствует

разделительная полоска, так как при этом утрачиваются их свойства. С помощью различных технологий ретардирования созданы четыре лекарственные формы пролонгированного действия:
Таблетки ретард (slow release, extended release) с послойным содержанием вещества и биополимера 12 и 24-часового действия разработаны для: антагонистов кальция (нифедипин SR, фелодипин ER,дилтиазем SR),теофиллина, индапамида, НПВС (диклофенак), нитратов (изосорбида динитрат, изосорбида мононитрат), пентоксифиллина, хинидина (хинидин сульфат), новокаинамида (прокаинамида гидрохлорид), β-адреноблокаторов (метапролол, окспренолол);
Слайд 83Сублингвальное и защечное (буккальное) введение
Слизистая оболочка ротовой полости имеет обильное кровоснабжение, поэтому

всасывающие через нее вещества быстро попадают в системный кровоток и начинают действовать.
При сублингвальном применении ЛС не подвергается воздействию желудочного сока и не биотрансформируется, так как попадает в системный кровоток, минуя печень. Особенно часто сублингвально применяют нитроглицерин для купирования приступов стенокардии, а также нифедипин и клофелин при гипертензивных кризах.
Слайд 84Сублингвальное и защечное (буккальное) введение
Рекомендации. При внутривенном следует держать под языком до

полного рассасывания. Проглатывание нерастворившейся части лекарства со слюной снижает эффективность этого пути введения лекарства. При частом сублингвальном применении ЛС возможно раздражение слизистой оболочки ротовой полости.
Слайд 85Сублингвальное и защечное (буккальное) введение
Другой разновидностью введения ЛС через слизистую оболочку полости

рта является защечный (буккальный способ). Для этого используют специальные лекарственные формы, которые, с одной стороны, обеспечивают быстроту всасывания в полости рта, а с другой, позволяют пролонгировать всасывание с целью увеличения продолжительности действия препарата.
Примером может служить тринитролонг – буккальная лекарственная форма нитроглицерина, представляющая собой пластинку из биополимерной основы, которую наклеивают на слизистую оболочку десны или щеки.
Слайд 86Ректальное введение
Прямая кишка имеет густую сеть кровеносных и лимфатических сосудов. Поэтому

многие лекарственные вещества (особенно неионизированные жирорастворимые соединения) хорошо всасываются с поверхности ее слизистой оболочки. Вещества, абсорбирующийся в нижней части прямой кишки, через нижние геморроидальные вены попадают в системный кровоток, минуя печень.
Ректально вводят свечи (ректальные суппозитории) и жидкости при помощи клизм. Этот путь введения ЛС используют для получения как местного (например, при язвенном колите), так и системного эффекта.
Слайд 87Ректальное введение
К недостаткам этого пути относят выраженные индивидуальные колебания скорости и полноты

всасывания препаратов, затруднения психологического характера и неудобства применения (на работе, в путешествии и т.д.)
Рекомендации. Ректальное введение препаратов позволяет избежать раздражения слизистой желудка. Кроме того, таким образом можно применять ЛС случаях, когда затруднено или неосуществимо их введение per os (тошнота, рвота, спазм или непроходимость пищевода).
Слайд 88Внутривенное введение
Внутривенное введение лекарственного вещества обеспечивает быстрое наступление эффекта, точное дозирование, быстрое

прекращение поступления препарата в кровяное русло при возникновении побочных реакций; возможность введения веществ, которые не всасываются из ЖКТ или раздражают его слизистую оболочку.
Время кровотока от вен верхних конечностей до языка составляет 13±3 секунд. Для большинства ЛС время введения, равное 4-5 таким циклам, достаточно для равномерного растворения препарата в крови. Таким образом, внутривенное введение позволяет значительно ускорить наступление терапевтического эффекта препарата.
Слайд 89Внутривенное введение
Рекомендации. При внутривенном введения ЛС следует соблюдать осторожность, так как попадание

лекарственного вещества в околовенозное пространство может вызвать сильное раздражение тканей, вплоть до некроза. При длительном использовании этого способа введения ЛС возможно развитие венозного тромбоза. Внутривенные инъекции являются также основным путем инфицирования вирусами гепатита В и ВИЧ.
Слайд 90Внутриартериальное введение
Для лечения некоторых заболеваний (печени, конечностей, сердца) лекарственные вещества, которые быстро

метаболизируются или связываются тканями, вводят в артерию.
Например, интракоронарное введение тромболитиков или интракаротидное введение антибиотиков.
При этом высокая концентрация препарата создается только в соответствующем органе, а системного действия удается избежать.
Рекомендации. Следует помнить, что возможный тромбоз артерии является значительно более серьезным осложнением, чем тромбоз вены.
Слайд 91Внутримышечное введение
При внутримышечном введении препарата обеспечивается относительно быстрое наступление эффекта (растворимые лекарственные

вещества всасываются в течение 10-30 мин).
Таким образом, можно применять ЛС, оказывающие умеренное раздражающее действие, а также депо-препараты. Объем вводимого вещества не должен превышать 10 мл. После внутримышечного введения препаратов могут появиться местная болезненность и даже абсцессы.
Слайд 92Внутримышечное введение
Рекомендации. Не следует делать инъекции вблизи нервных стволов, так как раздражающие

вещества могут повреждать нервные волокна, в результате чего появляются сильные боли, а иногда парез мышц. Опасным может оказаться случайное попадание иглы в кровеносный сосуд.
Слайд 93Ингаляционное введение
При ингаляционном введении лекарственные вещества быстро всасываются и оказывает как местное,

так и системное действие в зависимости от степени их липофильности.
Ингаляционное введение ЛС позволяет ускорять время всасывания, обеспечивать избирательность действия на дыхательную систему, вводить газообразные и летучие вещества.
Слайд 94Ингаляционное введение
Ингаляционное лекарственные вещества вводят в виде:
Аэрозолей (β2-адреномиметики, кортикостероиды, антибиотики);
Газов (летучие анестетики).

Ингаляционный способ введения является единственной возможностью применения газообразных ЛС (эфир для наркоза, фторотан);
Порошков (хромогликаты, кортикостероиды).
Слайд 95Ингаляционное введение
Достижение того или иного результата зависит от степени проникновения лекарственного вещества

в бронхиальном дереве (бронхи, бронхиолы, альвеолы). Ингаляционное введение может ускорять всасывание, если частицы препарата будут проникать в наиболее дистальные отделы бронхиального дерева, т.е. в альвеолы, где всасывание происходит через тонкие стенки альвеол и имеет большую площадь.
Например, нитроглицерин при ингаляционном введении поступает непосредственно в системный кровоток, в отличие от энтерального способа введения.
Слайд 96Ингаляционное введение
Для достижения избирательного действия ЛС на дыхательную систему, например, при лечении

бронхиальной астмы, необходимо распределение основной
Массы лекарственного препарата в бронхах среднего и мелкого калибра. Вероятность системных эффектов зависит от количества вещества, попавшего в общий кровоток. Для ингаляционного введения применяются специальные системы доставки:
Дозируемый аэрозольный ингалятор, содержащий газ-пропеллент;
Ингалятор для введения сухого порошкообразного вещества, активируемый дыханием (турбухйлер);
Небулайзер.
Слайд 97Ингаляционное введение
Поступление ЛС при этом зависит от размера частиц препарата, техники ингалирования

и обьемной скорости входа. При применении большинства аэрозольных ингаляторов в дыхательную систему попадает не более 20-30% общей дозы лекарственного вещества (респирабельная фракция). Остальная часть препарата задерживается в полости рта и глотки, а затем проглатывается, определяя развитие системных эффектов, чаще нежелательных.
Слайд 98Ингаляционное введение
Последние технологии создания ингаляционных форм доставки – порошковые ингаляторы – позволяют

увеличить респирабельную фракцию препарата до 30-50%. Порошковые ингаляторы основаны на создании турбулентных потоков, которые сильной струей воздуха размельчают крупные частицы сухого лекарственного вещества, в результате чего они лучше достигают дистальных отделов дыхательных путей.
Слайд 99Ингаляционное введение
Преимуществом порошковых ингаляторов является отсутствие газа пропеллента, негативно сказывающегося на окружающей

среде. Ингаляторы для введения сухого порошкообразного вещества разделяются по способам использования лекарства – оно либо встроено в ингалятор, либо прилагается к ингалятору в виде специальной лекарственной формы.
Слайд 100Ингаляционное введение
Ингаляторы, активируемые дыханием (турбухйлеры), облегчают поступление лекарственного вещества в дыхательные пути,

так как не требуют координирования входа и нажатия на баллончик ингалятора; лекарство поступает в дыхательные пути при вдохе меньшего усилия, что увеличивает эффект от лечения.
Другой путь повышения респирабельной фракции при использовании ингаляторов заключается в применении вспомогательных устройств типа спейсеров и небулайзеров.
Слайд 101Ингаляционное введение
Ингаляционным путем невозможно применение раздражающих лекарственных веществ. При использовании газообразных веществ

прекращение ингаляции ведет к быстрому прекращению их действия.
Рекомендации. Следует помнить о возможном действии ингалируемых лекарственных препаратов, например, средств для наркоза, на окружающих людей. Кроме того, при ингаляциях лекарственные вещества поступают сразу в левые отделы сердца через легочные вены и могут оказать кардиотонические действие.
Слайд 102Трансдермальное введение
Нанесение ЛС на поверхность кожи или слизистых оболочек используется для

получения локального эффекта. Однако некоторые вещества при нанесении их на слизистые оболочки носа, глаз и даже кожу могут всасываться и оказывать системное действие.
Например, длительное применение мазей с глюкокортикоидами приводит к возникновению у больного побочных реакций, подобных таковым при пероральном применении этих препаратов.
Слайд 103Трансдермальное введение
В последние время разработаны особые трансдермальные лекарственные формы, которые фиксируются клейким

веществом на коже (пластыри, диски) и обеспечивают медленное и длительное всасывание ЛС, за счет чего увеличивается продолжительность его действия. Эти трансдермальные системы позволяют контролировать дозирование лекарственных веществ путем регулирования площади пластыря или диска.
Таким путем вводят, например, нитроглицерин и скополамин.
Слайд 104Трансдермальное введение
Осмо-Адалат: пример желудочно-кишечной терапевтической системы
Необходимость в ретардных лекарственных препаратах, имеющих прямую

связь между концентрацией ЛВ в крови и фармакологическим эффектом. Резкие колебания максимальной и минимальной концентрации ЛВ в течение междозового интервала могут быть причиной развития неблагоприятных эффектов или недостаточной эффективности; такие препараты должны иметь достаточную «остаточную» концентрацию в конце интервала дозирования.
Слайд 105Трансдермальное введение
Наибольшее клиническое значение имеют ретардные формы гипотензивных препаратов, в частности антагонистов

кальция. Короткодействующие лекарственные формы антагонистов кальция характеризуется значительными колебаниями их концентрации в плазме крови в течение интервала дозирования и небольшой продолжительностью гипотензивного эффекта (не более 6 ч), что требует частого 3-4кратного дозирования. Кроме того, быстрое нарастание концентрации антагонистов кальция в крови сопровождается резкой вазодилатацией, в ответ на которую в организме происходит активация стрессовых систем, в первую очередь симпатоадреналовой, что вызывает ряд неблагоприятных эффектов (головная боль, головокружение, рефлекторная тахикардия, резкая гиперемия).
Слайд 106Трансдермальное введение
С другой стороны, короткая продолжительность их действия означает наличие бесконтрольного периода

в ранние утренние часы, что опасно развитием различных сердечно-сосудистых осложнений (инсульта, инфаркта миокарда и др.). Поэтому важно, чтобы продолжительность действия гипотензивного препарата составляла не менее 24 ч. Ретардные лекарственные формы, особенно лекарственные терапевтические системы (Осмо-Адалат), позволяют обеспечивать контроль уровня АД на протяжении суток при однократном приеме, улучшить переносимость ввиду отсутствия резкого изменения концентрации в плазме и плавного развития гемодинамических эффектов, и улучшить приверженность лечению больных. Например, частота побочных эффектов Осмо-Адалата в сравнении с нифедипином уменьшается в 3 раза (10% и 33% соответственно).
Слайд 107Всасывание лекарственных средств
Всасывание – процесс поступления лекарственного вещества из места введения в

кровь.
Всасывание зависит от пути введения и лекарственной формы, растворимости лекарственного вещества в липидах и скорости кровотока в месте введения. Прохождение большинства лекарств через слизистую оболочку ЖКТ определяется их растворимостью в липидах и ионизацией. Естественно, что при внутривенном и внутриартериальном введении о всасывании говорить не приходится – лекарство сразу и полностью попадает в системный кровоток.
Слайд 108Всасывание лекарственных средств
Основные механизмы всасывания:
Пассивная диффузия, свойственная липофильным (растворимым в липидах)

лекарственным веществам;
Фильтрация, характерная для гидрофильных (растворимых в воде) лекарств;
Некоторые вещества всасываются путем активного транспорта.
Слайд 109Показатели всасывания
Полнота всасывания – количество (в%) всосавшегося вещества.
Время достижения максимальной концентрации

(Тmaх)-скорость всасывания лекарственного вещества и скорость наступления терапевтического эффекта.
Константа скорости абсорбции (Ка)-скорость поступления препарата в кровь из места введения.
Период полуабсорбции (Т1/2а)-время, необходимое для поступления в кровеносное русло половины дозы препарата из места введения; обратно пропорционально константе скорости абсорбции (Т 1/2а= 0,693/Кα).
Слайд 110Факторы, влияющие на всасывание ЛС
Всасывание лекарственных средств, являющихся слабыми электролитами, зависит

от степени их ионизации: диффузии подвергаются молекулы, находящиеся в недиссоциированном состоянии; диссоциация на ионы прекращает процесс диффузии, но при этом возможно всасывание путем фильтрации. Поэтому степень и механизм всасывания для электролитов определяется рН среды, в которую они попадают.
Слайд 111Факторы, влияющие на всасывание ЛС
В различных отделах ЖКТ рН имеет разные значения

– около 2 в желудке, в двенадцатиперстной кишке – 4-8,5, в нижних отделах толстой кишки – 8, что определяет способность разных лекарств всасываться в том или ином отделе ЖКТ. Кислоты легче всасываются в желудке, а основания – в тонкой или толстой кишке.
Под действием кислой среды желудка некоторые ЛС ( например, бензилпенициллин и эритромицин) могут разрушаться.
Слайд 112Факторы, влияющие на всасывание ЛС
На всасывание ЛС оказывают действие различные процессы в

ЖКТ: ферменты ЖКТ, которые способны инактивировать белки и полипептиды (АКТГ, вазопрессин, инсулин и т.д.), а также некоторые другие вещества (прогестерон, тестостерон, альдостерон).
Соли желчных кислот в свою очередь могут ускорить всасывание ЛС или замедлить его при образовании нерастворимых соединений.
На всасывание влияют также моторика ЖКТ, объем и состав пищи, количество принимаемой жидкости, интервал времени между едой и приемом препаратов.
Так молоко нарушает всасывание тетрациклинов, ампициллина и амоксициллина.
Слайд 113Пресистемный метаболизм
После прохождения через стенку желудка и/или кишечника лекарственное вещество поступает

в кровоток портальной системы и печень. Некоторые вещества, попадая в печень, под влиянием ее ферментов подвергаются значительным изменениям
Слайд 114Пресистемный метаболизм
Биотрансформацию вещества при первичном прохождении через печень в процессе всасывания называют

пресистемным метаболизмом или эффектом первичного прохождения (first pass metabolism).Интенсивность пресистемного метаболизма зависит от скорости печеночного кровотока.
Наиболее важные ЛС с высокой степенью пресистемного метаболизма – антагонисты кальция, липофильные β-адреноблокаторы, нитраты, ингибиторы АПФ.
Слайд 115Пресистемный метаболизм
Рекомендации. Для преодоления пресистемного метаболизма лекарств необходимо изменение режимов дозирования: увеличение

разовой дозы препарата и сокращение интервалов между приемами.
На эффекте первичного прохождения основано действие пролекарств (pro-drugs)- веществ, которые, подвергаясь пресистемному метаболизму, превращаются в активные вещества, вызывающие фармокологические эффекты.
Слайд 116Биодоступность лекарственных средств
Биодоступность – часть принятой внутрь дозы ЛВ, которая достигла

системного кровотока в неизменном виде активных метаболитов, образовавшихся в процессе всасывания в результате пресистемного метаболизма.
Слайд 117Основные показатели биодоступности
Абсолютная биодоступность (f)-часть дозы препарата (в %), которая достигла

системного кровотока после вне сосудистого введения.
Относительную биодоступность (f') – определяют с целью сравнения биодоступности двух лекарственных форм для вне сосудистого введения.
Слайд 118Основные показатели биодоступности
На биодоступность ЛС влияют следующие факторы:
Путь введения ЛС;
Индивидуальные особенности организма

больного, состояние его ЖКТ, сердечно- сосудистой системы, печени, почек;
Биофармацевтические факторы (лекарственная форма, ее состав, особенности технологии производства препарата).
Слайд 119Основные показатели биодоступности
При внутривенном введении лекарство полностью попадает в кровеносное русло и

его биодоступность равна 100%.
При использовании других путей введения (пероральный, внутримышечный, подкожное введение и др.) лекарство должно пройти через ряд мембран клеток (слизистой оболочки желудка, печени, мышц и т.д.), при этом только часть его попадает в системный кровоток и биодоступность почти никогда не достигает 100%
Слайд 120Основные показатели биодоступности
Биофармацевтические факторы особенно важны для пероральных форм в виде таблеток,

капсул. Как правило, вспомогательные вещества (наполнители, полимерные пленки, сахара и т.п.), входящие в состав лекарственного препарата, индифферентны и не оказывают какого-либо фармакологического действия, но иногда они влияют на биодоступность препарата. Для прессования таблеток и наполнения капсул используют вещества, которые могут отрицательно повлиять на скорость растворения действующего вещества. Его растворению может препятствовать низкая диспергируюшая способность частиц наполнителя, а их дезагрегации способствует поверхностно-активные или другие вещества, влияющие на электростатические свойства частиц.
Слайд 121Основные показатели биодоступности
Технология грануляции порошков на фармацевтических заводах также влияет на характер

высвобождения действующего вещества из лекарственной формы. Немаловажное значение для биодоступности препаратов имеют характер и состав покрытия таблеток и капсул. Препарат Флемоксин солютаб: пример увеличения биодоступности амоксициллина.
Слайд 122Основные показатели биодоступности
Биодоступность можно увеличить за счет совершенствования лекарственной формы препарата и

его фармацевтических свойств. Как уже говорилось, биодоступность ЛС может изменяться при различных физиологических и патологических состояниях (старение, заболевания печени, сердечная и почечная недостаточность, генетические дефекты метаболизирующих ферментов и др.). Снижение биодоступности для отдельных лекарств наблюдается при приеме пищи (особенно жирной или богатой углеводами), усилении активности метаболизирующих ферментов.
Повышение биодоступности и, следовательно, увеличение концентрации и общего содержания препарата в организме может происходить за счет снижения его метаболизма при эффекте первичного прохождения.
Слайд 123Основные показатели биодоступности
Так, хорошо растворимая таблетка амоксициллина (Флемоксин солютаб) позволяет увеличить его

биодоступность засчет более быстрого всасывания и более высоких концентраций в крови, повышения показателя "площадь под кривой концентрация-время».
Лучшая биодоступность этой лекарственной формы позволяет достичь наиболее хороших результатов при лечении инфекций дыхательных путей, эрадикации Н. pylori на фоне снижения неблагоприятных эффектов со стороны желудочно-кишечного тракта.
Слайд 124Распределение лекарственных средств
Распределение лекарственных средств - это накопление и проникновение лекарственного вещества

в различные ткани, органы и жидкие среды организма. Степень накопления лекарственного вещества в тканях определяет в конечном счете выраженность фармакодинамического эффекта.
Показатели распределения;
Слайд 125Распределение лекарственных средств
Кажущаяся начальная концентрация (Сο) - концентрация препарата, которая была бы

достигнута в плазме крови при внутривенном его введении и мгновенном распределении по органам и тканям.
Максимум (пик) концентрации лекарственного вещества в крови (Сmax) - максимальная концентрация лекарственного вещества в системном кровотоке после парентерального или перорального введения.
Слайд 126Распределение лекарственных средств
Стационарная (равновесная) концентрация (Сss) – концентрация препарата, которая установится в

плазме крови при поступлении его в организм с постоянной скоростью. При прерывистом введении (приеме) ЛС через одинаковые промежутки времени в одинаковых дозах выделяют максимальную (Css max) и минимальную (Css min) равновесные концентрации.
Объем распределения препарата (Vd) – это степень его захвата тканями из плазмы крови. Объем распределения описывается формулой: Vd=d\Co, где Vd-условный объем жидкости, в котором нужно растворить всю попавшую в организм дозу препарата (D), чтобы получилась концентрация, равная кажущейся начальной концентрации в сыворотке крови (Co).
Слайд 127Факторы, влияющие на распределение ЛС
После попадания в системный кровоток лекарственное вещество

распределяется по различным органам и тканям организма.
Характер распределения лекарственного средства определяется сочетанием нескольких факторов, в том числе:
Интенсивностью регионарного кровотока;
Степенью связывания ЛВ с белками плазмы крови и тканевыми структурами;
Растворимостью ЛВ в липидах.
Знание объема распределения (Vd) лекарственного средства в организме помогает при выборе пути введения и дозирования препарата
Слайд 128Лекарственные средства с маленьким объемом распределения
Большая часть лекарственного средства в первые

минуты после всасывания попадает в те органы и ткани, которые наиболее активно кровоснабжаются:
Почки, легкие, мозг, надпочечники, щитовидная железа (скорость перфузии – более 1 мл/мин);
Печень, сердце, селезенка (скорость перфузии – 0,1 – 1 мл/мин);
Затем в менее интенсивно кровоснабжаемые органы:
Мышцы, слизистые оболочки, кожа и жировая ткань, кости (скорость перфузии – менее 0,1 мл/мин).
Слайд 129Факторы, влияющие на распределение ЛС
Для достижения терапевтических концентраций лекарственного средства в тканях

с низкой (менее 0,1 мл/мин) скоростью перфузии требуется от нескольких минут до нескольких часов.
Важным фактором, определяющим распределение лекарственного средства, является скорость его диффузии в различные ткани. Легко и быстро происходит диффузия в интерстициальную ткань. Капилляры хорошо проницаемы и для гидрофильных, и для липофильных веществ, поэтому водорастворимые лекарства (например, стрептомицин), которые плохо всасываются из кишечника, вводят парентерально.
Гидрофильные ЛС имеют маленький объем распределения – менее 0,2 л/кг, липофильные – большой (более 0,2 л/кг).
Слайд 130Связывание лекарственных средств с белками крови и тканей
Многие лекарственные средства обладают выраженным

физико-химическим сродством к различным белкам плазмы крови, прежде всего к альбуминам. Связывание их с белками плазмы приводит к снижению концентрации вещества в тканях и месте действия, так как только свободный (не связыванный) препарат проходит через мембраны. Вещество, находящееся в комплексе с белком, лишено фармакологической активности. Свободная и связыванная фракции лекарственного средства находятся в состоянии динамического равновесия: по мере уменьшения концентрации свободной фракции в плазме крови, вследствие ее распределения, вещество высвобождается из связи с белком.
Слайд 131Связывание лекарственных средств с белками крови и тканей
Степень связывания с белками плазмы

влияет на объем распределения лекарственного средства, а. следовательно, на скорость наступления терапевтического эффекта:
Так, ЛС, характеризующиеся невысокой степенью связи с белками плазмы (< 50%), быстро распределяются в организме и очень скоро дают терапевтический эффект; но также быстро элиминируется, поэтому эффект сохраняется непродолжительное время;
ЛС, обладающие высокой степенью связи с белками плазмы (>90%), наоборот, крайне медленно накапливаются в тканях, поэтому терапевтическая концентрация создается долго, и эффект наступает постепенно. Такие ЛС медленно элиминируется из организма, обеспечивая длительное удержание терапевтического эффекта.
Слайд 132Связывание лекарственных средств с белками крови и тканей
Наиболее часто лекарственные средства связываются

с альбуминами, но возможна связь и с другими белками – кислым α -гликопротеином, липопротеинами, глобулинами. Нарушение связывания наблюдается при снижении концентрации альбуминов в крови (гипоальбуминемия) и связывающей способности белков крови при некоторых заболеваниях печени и почек.
Даже снижение уровня альбуминов в крови до 30 г/л (в норме 33-55 г/л) может привести к значительному повышению содержания свободной фракции фенитоина. Клинически значимое повышение уровня свободной фракции фуросемида происходит при снижении количества альбумина до 20 г/л.
Слайд 133Связывание лекарственных средств с белками крови и тканей
Степень связи с белками плазмы

может изменяться при различных патологических состояниях. Наибольшее клиническое значение это может иметь для ЛС, связывающихся с белками крови более чем на 90%, даже незначительное нарушение связывания с белком может существенно изменять концентрацию свободной фракции лекарственного средства и влиять на выраженнсть эффекта (таб.6).
Рекомендации. Осведомленность о степени связывания лекарственного средства с белками плазмы помогает рационально выбирать препарат в неотложных ситуациях, когда требуется получить немедленный эффект, а также определить сроки наступления терапевтического эффекта.
Слайд 134Выведение лекарственных средств
Выведение (элиминация) – процесс удаления лекарственного средства из организма,

который включает в себе его нейтрализацию (биотрансформацию или метаболизм) и собственно экскрецию.
Слайд 135Параметры выведения (элиминации)
Константа скорости элиминации (Кel) – скорость исчезновения препарата из

организма путем биотрансформации и выведения.
Период полувыведения (Т1/2) – время, необходимое для уменьшения вдвое концентрации препарата в плазме крови, зависит от константы скорости элиминации (Т1/2 = 0,693/ Кel).
Общий клиренс лекарственного средства (Clt) – обьем плазмы крови, очищаемой от лекарств за единицу времени (мл/мин) за счет выведения почками, печенью и т.д. Общий клиренс представляет собой сумму почечного и печеночного клиренса.
Слайд 136Параметры выведения (элиминации)
Внепочечный клиренс (Cler) – выведение лекарства другими путями (прежде всего

с желчью).
Константа скорости экскреции (Kex) – скорость выведения препарата с мочой, калом, слюной и др.
Слайд 137Биотрансформация
Биотрансформация (метаболизм) – комплекс физико-химических и биохимических превращений ЛС, в процессе которых

образуются полярные водорастворимые вещества (метаболиты), способные выводиться из организма. В большинстве случаев метаболиты ЛС менее биологически активны и менее токсичны, чем исходные соединения. Однако биотрасформация в организме некоторых веществ приводит к образованию более активных по сравнению с ними метаболитов.
Печень является основным органом, где происходит метаболизм лекарственных веществ. Кроме того, отдельные вещества могут подвергаться биотрансформации в почках (например, имипенем), плазме крови и других тканях (например, в стенке кишечника).
Слайд 138Биотрансформация
Различают два типа реакций метаболизма ЛС в организме:
Несинтетические, к которым относят: микросомальные

– реакции, катализируемые ферментами эндоплазматического ретикулюма; немикросомальные – реакции, катализируемые ферментами другой локализации. К несинтетическим реакциям относят окисление, восстановление и гидролиз.
Слайд 139Биотрансформация
Синтетические, в основе которых лежит конъюгация ЛС с эндогенными субстратами или некоторыми

химическими группировками (глюкуроновая кислота, сульфаты, глицин, глутатион, метильные группы и др.). в конъюгации участвует многие ферменты (например, глюкуронилтрансфераза, сульфотрансфераза, метилтрансфереза). После завершения реакции молекула препарата становится более полярной и, следовательно, легче выводится из организма.
Слайд 140Биотрансформация
В зависимости от способности ЛС влиять на активность микросомальных ферментов их разделяют

на:
Вещества-ингибиторы метаболизма, снижающие активность микросомальных ферментов;
Вещества-индукторы метаболизма, повышающие активность микросомальных ферментов.
Слайд 141Биотрансформация
Индукторы усиливают не только метаболизм лекарственных веществ в печени, но и их

выведение с желчью. Причем ускоряется метаболизм не только вводимых вместе с ними препаратов, но и самых индукторов
Слайд 142Биотрансформация
Немикросомальная биотрансформация ЛС происходит главным образом в печени, но может осуществляться также

в плазме крови и других тканях.
Хотя немикросомальные ферменты участвуют в биотрансформации небольшого числа лекарственных веществ, они все же играют важную роль в метаболизме. Все виды конъюгации (исключая глюкуронидную), восстановления и гидролиза лекарственных веществ катализируются немикросомальными ферментами. Такие реакции вносят вклад в биотрансформацию ряда распространенных ЛС, в том числе ацетилсалициловой кислоты и сульфаниламидов.
Слайд 143Биотрансформация
При пероральном применении ЛС, всасывающиеся слизистой оболочкой кишечника, поступают сначала в портальную

систему, а лишь затем в системный кровоток. Многочисленные интенсивные реакции метаболизма (почти все известные синтетические и несинтетические реакции) протекают уже в стенке кишечника. Например, изадрин подвергается конъюгации с сульфатами, гидралазин – ацетилированию. Некоторые ЛС метаболизируются неспецифическими ферментами (пенициллины, аминазин) или бактериями кишечника (метотрексат, леводопа), что может иметь клиническое значение. Так, у некоторых больных абсорбция аминазина снижена до минимума вследствие значительного его метаболизма в кишечнике.
Слайд 144Печеночный клиренс
Основными физиологическими факторами, влияющими на печеночный клиренс, являются:
Состояние печени;
Объем притекающей крови;
Скорость

печеночного кровотока;
Слайд 145Печеночный клиренс
Функциональная способность соответствующих ферментов.
Например, клиренс лидокаина, который интенсивно метаболизируется ферментами

печени, зависит прежде всего от скорости его доставки к печени, т.е. от объема притекающей крови и скорости кровотока. Поэтому при уменьшении печеночного кровотока в результате застойной сердечной недостаточности клиренс лидокаина снижается. С другой стороны, клиренс фенотиазинов зависит в основном от функционального состояния ферментов. Поэтому при поражении гепатоцитов клиренс фенотиазинов резко снижается и, соответственно, значительно возрастает их концентрация в крови. 139
Слайд 146Печеночный клиренс
ЛС с высоким печеночным клиренсом (flow limited drugs), для которых характерна

высокая степень экстракции гепатоцитами из крови. Способность печени метаболизировать эти ЛС зависит от скорости кровотока;
ЛС с низким печеночным клиренсом (capacity limited drugs), у которых печеночный клиренс зависит не от скорости кровотока, а от емкости ферментных систем печени, метаболизирующих данные препараты.
Такие препараты могут обладать высокой (дифенин, хинидин, толбутамид) или низкой степенью связывания с белками (теофиллин, парацетамол, левомицетин). Их метаболизм зависит прежде всего от степени их связывания с белками. 140
Слайд 147Биотрансформация Печеночный клиренс
На биотрансформацию ЛС в организме также влияют возраст, пол, окружающая

среда, характер питания, заболевания и т.д. Все ЛС, вводимые внутрь, разделяют на две группы
141
Слайд 148Пути выведения
Выведение лекарственных веществ из организма осуществляет несколькими путями в зависимости от

растворимости веществ в липидах или воде:
Почечная экскреция – основной путь выведения (элиминации);
Печеночная экскреция – экскреция лекарственных веществ и их метаболитов с желчью;
Другие пути (выведение ЛВ с выдыхаемым воздухом , потом, слюной и слезной жидкостью)
Слайд 149Пути выведения
Другие пути выведения или внепочечный метаболизм не имеют существенного значения и

при расчете общего клиренса во внимание обычно не принимаются.
Например, почечный клиренс циметидина составляет около 600 мл/мин, печеночный – 200 мл/мин и 10 мл/мин; следовательно, общий клиренс равен 810 мл/мин. О выведении лекарственного вещества из организма судят по Т1/2: за один Т1/2 из организма выводится 50% вещества, за два – 75%, за три- 90%. Т1/2 служит главным образом для определения интервала дозирования лекарственного препарата и промежутка времени, необходимого для достижения равновесной его концентрации в крови (это обычно 3-5 Т1/2).
143




















































































































































 Дифференциальная диагностика и лечение при легочном инфильтрате
Дифференциальная диагностика и лечение при легочном инфильтрате Туберкулёз. Основные симптомы. Профилактика
Туберкулёз. Основные симптомы. Профилактика Урология. Илеоцистопластика
Урология. Илеоцистопластика Интраоперационная инфузия. Обоснование.Тактика и объем
Интраоперационная инфузия. Обоснование.Тактика и объем Септический шок в акушерско - гинекологической практике
Септический шок в акушерско - гинекологической практике Вирусные гепатиты
Вирусные гепатиты Профилактика сердечно-сосудистых заболеваний
Профилактика сердечно-сосудистых заболеваний Основы трансфузиологии
Основы трансфузиологии Сигналінг
Сигналінг Формы ДЦП
Формы ДЦП Способы транспортировки пострадавшего. Изготовление носилок из подручных средств
Способы транспортировки пострадавшего. Изготовление носилок из подручных средств Жизнь с пузырчаткой
Жизнь с пузырчаткой Классификация и виды отклонений в развитии и поведении детей и подростков
Классификация и виды отклонений в развитии и поведении детей и подростков Проект: Луч надежды
Проект: Луч надежды Гипотиреодты кома диагностикасы
Гипотиреодты кома диагностикасы Методы исследования и особенности системы дыхания у детей
Методы исследования и особенности системы дыхания у детей Covid-19: диагностика, инновационные методы лечения, клеточная терапия
Covid-19: диагностика, инновационные методы лечения, клеточная терапия Корреляция структуры ксенобиотика и его токсичности. Топологические индексы
Корреляция структуры ксенобиотика и его токсичности. Топологические индексы Первая помощь в разных случаях
Первая помощь в разных случаях Кровеносная система человека
Кровеносная система человека Воспаление головного мозга
Воспаление головного мозга Үрпіден сүртінді алу
Үрпіден сүртінді алу Внебольничная пневмония в условиях терапевтического участка
Внебольничная пневмония в условиях терапевтического участка Детская деменция
Детская деменция Синдром Марфана
Синдром Марфана Кесарево сечение
Кесарево сечение Первичный туберкулез тренинг по основным формам первичного туберкулеза легких
Первичный туберкулез тренинг по основным формам первичного туберкулеза легких Искусство мануальных
Искусство мануальных