Содержание
- 2. Коронавирусная инфекция (COVID-19) – острое вирусное заболевание, вызываемое РНК- геномным вирусом SARS-CoV-2, симптомы которого варьируют от
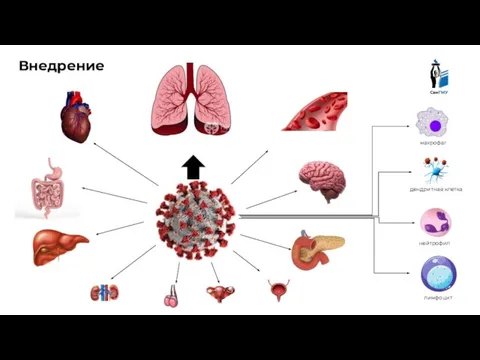
- 3. в мире в России в Самарской области Состояние проблемы на сегодняшний день SARS-CoV-2 приводит к отеку
- 4. макрофаг дендритная клетка нейтрофил лимфоцит Внедрение
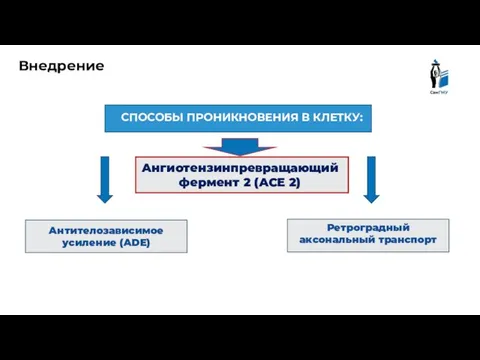
- 5. СПОСОБЫ ПРОНИКНОВЕНИЯ В КЛЕТКУ: Внедрение Антителозависимое усиление (ADE) Ретроградный аксональный транспорт Ангиотензинпревращающий фермент 2 (ACE 2)
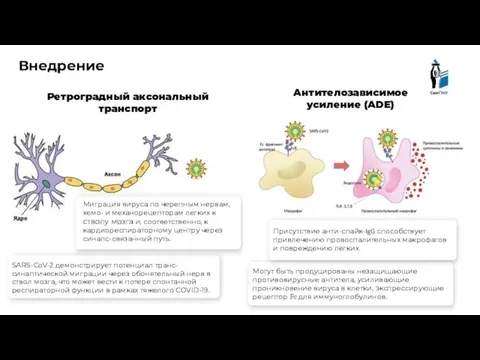
- 6. Внедрение Антителозависимое усиление (ADE) Ретроградный аксональный транспорт Могут быть продуцированы незащищающие противовирусные антитела, усиливающие проникновение вируса
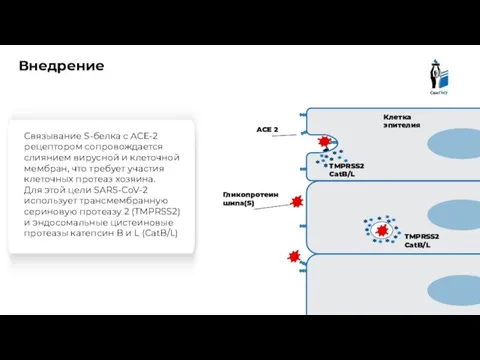
- 7. Внедрение Связывание S-белка с ACE-2 рецептором сопровождается слиянием вирусной и клеточной мембран, что требует участия клеточных
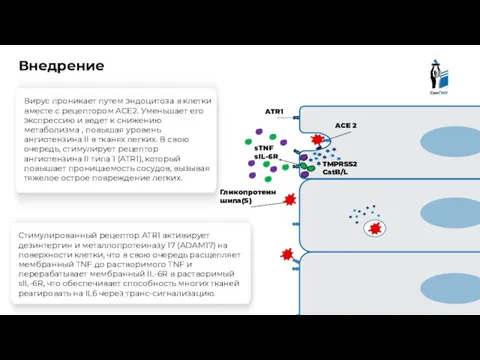
- 8. Гликопротеин шипа(S) ACE 2 Клетка эпителия Внедрение Вирус проникает путем эндоцитоза в клетки вместе с рецептором
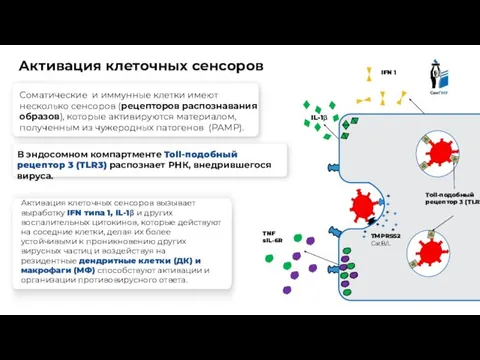
- 9. Клетка эпителия Активация клеточных сенсоров TNF sIL-6R Toll-подобный рецептор 3 (TLR3) IFN 1 Соматические и иммунные
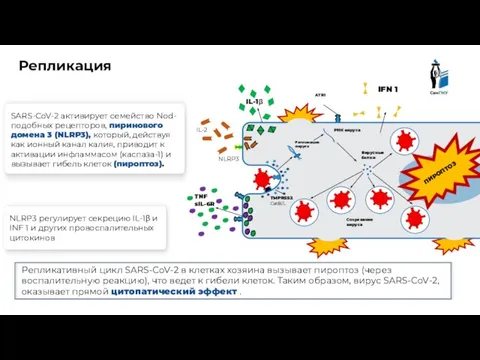
- 10. Клетка эпителия Репликация ATR1 TNF sIL-6R Репликация вируса Вирусные белки РНК вируса SARS-CoV-2 активирует семейство Nod-подобных
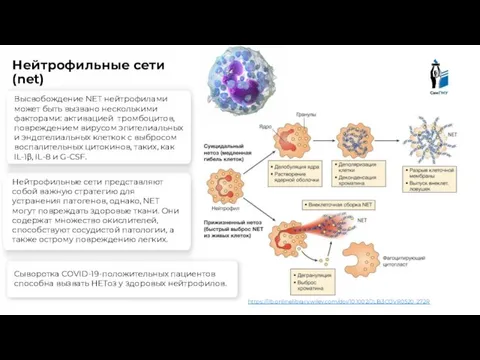
- 11. Нейтрофильные сети представляют собой важную стратегию для устранения патогенов, однако, NET могут повреждать здоровые ткани. Они
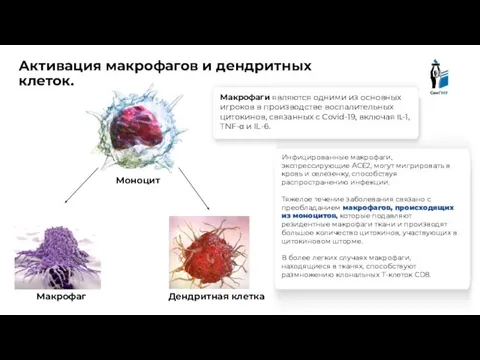
- 12. Инфицированные макрофаги, экспрессирующие ACE2, могут мигрировать в кровь и селезенку, способствуя распространению инфекции. Тяжелое течение заболевания
- 13. Рекрутинг и активация CD4 T-клеток. Рекрутирование противовирусных Т-клеток происходит в основном в дренирующих перибронхиальных лимфатических узлах,
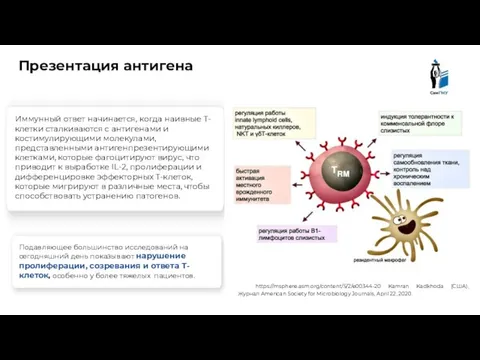
- 14. Презентация антигена https://msphere.asm.org/content/5/2/e00344-20 Kamran Kadkhoda (США), Журнал American Society for Microbiology Journals, April 22, 2020. Иммунный
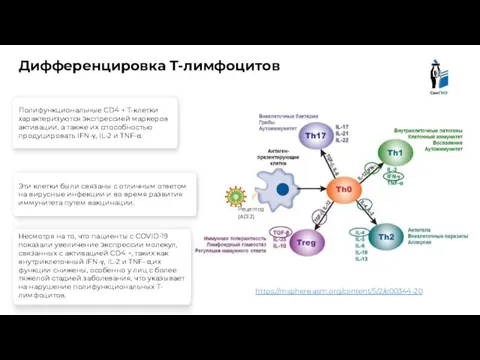
- 15. https://msphere.asm.org/content/5/2/e00344-20 Дифференцировка Т-лимфоцитов Рецептор (ACE2) Полифункциональные CD4 + Т-клетки характеризуются экспрессией маркеров активации, а также их
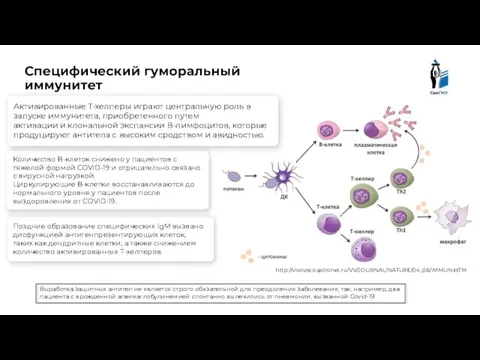
- 16. Специфический гуморальный иммунитет http://vivovoco.astronet.ru/VV/JOURNAL/NATURE/04_06/IMMUN.HTM Выработка защитных антител не является строго обязательной для преодоления заболевания, так, например,
- 17. Цитокиновый состав шторма Термин «цитокиновый шторм» был впервые введен в употребление в 1993 году для описания
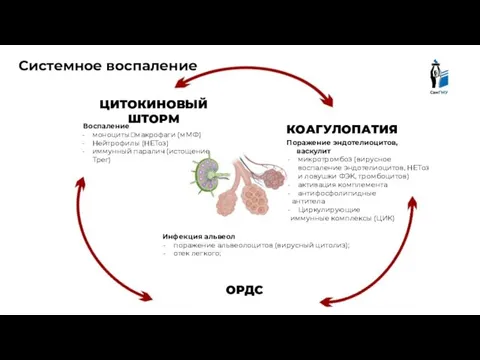
- 18. ЦИТОКИНОВЫЙ ШТОРМ ОРДС КОАГУЛОПАТИЯ Воспаление моноциты?макрофаги (мМФ) Нейтрофилы (НЕТоз) иммунный паралич (истощение Трег) Поражение эндотелиоцитов, васкулит
- 19. Вывод Главной особенностью иммунной системы пациентов с тяжелым течением новой коронавирусной инфекцией - COVID-19 является наличие
- 21. Скачать презентацию




 Гастростомия. Гастростомия жасауға
Гастростомия. Гастростомия жасауға Гастродуоденальное кровотечение, тактика лечения, методы остановки кровотечения
Гастродуоденальное кровотечение, тактика лечения, методы остановки кровотечения Железодефицитная анемия и В-12-дефицитная анемия в амбулаторной практике
Железодефицитная анемия и В-12-дефицитная анемия в амбулаторной практике Развитие концепции формы и функции в клинической ортодонтии
Развитие концепции формы и функции в клинической ортодонтии Сообщество Анонимные Наркоманы
Сообщество Анонимные Наркоманы Хроническая обструктивная болезнь лёгких
Хроническая обструктивная болезнь лёгких Вывихи и переломы
Вывихи и переломы Припасовка штампованных коронок
Припасовка штампованных коронок Патология сознания
Патология сознания Техника безопасности на занятиях гимнастикой
Техника безопасности на занятиях гимнастикой Подагра
Подагра Искусственный пищевод
Искусственный пищевод Гигиена одежды
Гигиена одежды Рак желудка
Рак желудка Как уберечься от гриппа
Как уберечься от гриппа Патофизиологические основы нефрологии
Патофизиологические основы нефрологии Заболевания шеи и щитовидной железы
Заболевания шеи и щитовидной железы Болезнь Гентингтона
Болезнь Гентингтона Самопроизвольное прерывание беременности
Самопроизвольное прерывание беременности Что такое ВИЧ? Принцип действия
Что такое ВИЧ? Принцип действия ВИЧ и Спид и их профилактика. 10 класс
ВИЧ и Спид и их профилактика. 10 класс Период новорождённости
Период новорождённости Постреанимационный синдром
Постреанимационный синдром Angina pectoris
Angina pectoris Гиподинамия. Профилактика гиподинамии
Гиподинамия. Профилактика гиподинамии Профилактика ОРВИ и Гриппа
Профилактика ОРВИ и Гриппа Совершенствование использования внутреннего потенциала учреждения здравоохранения
Совершенствование использования внутреннего потенциала учреждения здравоохранения Клетки крови. Строение и функции клеток крови
Клетки крови. Строение и функции клеток крови